1 L某混合溶液,可能含有的 离子如下表:
离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量( )与加NaOH溶液的体积(
)与加NaOH溶液的体积( )的关系如右图所示。则该溶液中确定含有的离子有_______________;
)的关系如右图所示。则该溶液中确定含有的离子有_______________;
不能确定是否含有的阳离子有__________,要确定其存在可补充做的实验是________;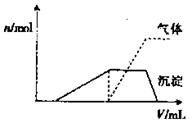
(2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入—定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的 关系如下表所示,分析后回答下列问题:
关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
 (Cl-) (Cl-) |
1.25mol |
1.5 mol |
2 mol |
 (Br-) (Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
 (I-) (I-) |
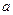 mol mol |
0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为___ 。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____________。
把CoCl溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,生成[CO(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。请写出表示此配合物结构的化学式:;此配合物中的Co化合价为。
元素X的原子最外层电子排布式为nsnnpn+l。原子中能量最高的是电子;元素X的氢化物的分子结构呈形;该氢化物可以与H+离子以____键相合。
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸,W的氯化物分子呈正四面体结构,W与Q形成高温陶瓷。这5个元素的氢化物分子中:
①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是;
②电子总数相同的氢化物的化学式和立体结构分别是。
1919年,Langlnuir提出等电子原理:原子数相同、电子总数相同的微粒,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:和。(任意写出一组即可)
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元 素组成的物质中,与NO-2互为等电子体的分子有:
素组成的物质中,与NO-2互为等电子体的分子有:
。(任意写出一个即可)
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)经验规律:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AIBr3中的化学键类型是。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系。
简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系
。
(3)某化合物分子中含有S-N键,该共用电子对偏向于原子(填元素符号)。