所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点
| |
Na |
Cu |
Al |
Fe |
| 熔点(0C) |
97.5 |
1083 |
660 |
1535 |
| 沸点(0C) |
883 |
2595 |
2200 |
3000 |
其中不能形成合金的是( )
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是
| A.反应开始时,正反应速率最大,逆反应速率为零 |
| B.随着反应的进行,正反应速率逐渐减小,最后为零 |
| C.随着反应的进行,逆反应速率逐渐增大,最后不变 |
| D.随着反应的进行,正反应速率逐渐减小,最后不变 |
一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列叙述正确的是
| A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(l) ΔH=-867 kJ·mol-1 |
| B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol |
| C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
已知下列热化学方程式:①Zn(s)+O2(g)===ZnO(s) ΔH1;②Hg(l)+O2(g)===HgO(s) ΔH2
则Zn(s)+HgO(s)===Hg(l)+ZnO(s) ΔH3,ΔH3的值为
| A.2ΔH2-ΔH1 | B.2ΔH1-ΔH2 | C.ΔH1-ΔH2 | D.ΔH2-ΔH1 |
已知:①2C(s)+O2(g)===2CO(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
下列说法中正确的是
| A.碳的燃烧热ΔH为0.5ΔH1kJ·mol-1 | B.②能表示CO燃烧热的热化学方程式 |
| C.碳的燃烧热ΔH=0.5(ΔH1+ΔH2) | D.碳的燃烧热小于CO的燃烧热 |
已知(1)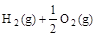 ===H2O(g)△H1=a kJ·
===H2O(g)△H1=a kJ·
(2)  ===2H2O(g)△H2=b kJ·
===2H2O(g)△H2=b kJ·
(3) 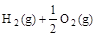 ===H2O(l)△H3=c kJ·
===H2O(l)△H3=c kJ·
(4)  ===2H2O(l)△H4=d kJ·
===2H2O(l)△H4=d kJ·
下列关系式中正确的是
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |