NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA |
| B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.0.1mol乙烷分子中含有的共价键数目为0.7NA |
| D.在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
在治理大气和水污染的措施中,不可行的是()
| A.抑制水中所有动植物的生长 |
| B.公共汽车改用清洁燃料车 |
| C.禁止使用含硫量高的劣质煤 |
| D.禁止排放未经处理的工业废水 |
有如下三个热化学方程式:
H2(g)+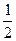 O2(g)====H2O(g)ΔH="a" kJ·mol-1
O2(g)====H2O(g)ΔH="a" kJ·mol-1
H2(g)+ 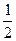 O 2(g)====H2O(l) ΔH="b" kJ·mol-1
O 2(g)====H2O(l) ΔH="b" kJ·mol-1
2H2O(l)====2H2(g)+O2(g)ΔH ="c" kJ·mol-1
关于它们的下列表述,正确的是()
| A.它们都是吸热反应 |
| B.a、b、c均为负值 |
| C.反应热的关系a="b" |
| D.反应热的关系2b=-c |
下列反应既是氧化还原反应,又是放热反应的是()
| A.铝片与稀H2SO4反应 |
| B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与CO2反应 |
| D.NaOH与HCl反应 |
下图显示了人类发展史上经济发展阶段与环境质量之间的关系。据图回答:根据这种关系,发展中国家应认识到()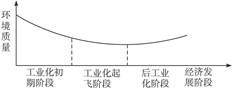
| A.环境污染不可避免,只能采取“先污染,后治理”的策略 |
| B.后工业化阶段环境问题会自然解决 |
| C.保护环境至关重要,必须杜绝兴建产生污染的工业设施 |
| D.应当采取措施减少或避免发展过程中的环境污染问题 |
下列各组物质的燃烧热相等的是()
| A.碳和一氧化碳 |
| B.1 mol碳和2 mol碳 |
| C.3 mol乙炔和1 mol苯 |
| D.淀粉和纤维素 |