A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与 其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置 , ,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是: 。
(2)D、F的气态氢化物,沸点较高的是 (填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14, 充分作用后,溶液pH 7(填“>”“<”或“=”),原因是
充分作用后,溶液pH 7(填“>”“<”或“=”),原因是  。
。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)①A原子的结构示意图为,
②B原子的电子式为,
③D的氢化物的电子式为,
④E的最高价氧化物的化学式为。
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A、B最高价氧化物对应水化物相互反应的化学方程式:
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示):
下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||
| 1 |
A |
|||||||||
| 2 |
D |
E |
G |
I |
||||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的碱是 ,酸性最强的酸是 ,呈两性的物质是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 ,最小的是 。
在NaCl、NaOH、N2、H2S中,只含有离子键的是,只含有极性键的是,只含有非极性键的是,既含有离子键又有极性键的是
(12分)乙炔是最简单的炔烃,实验室可以用电石(主要成分CaC 2)与水反应制备乙炔。乙炔是一种重要的有机化工原料,在催化剂存在的条件下,加热至150℃~160℃,乙炔与氯化氢发生反应,生成重要的化工原料氯乙烯。以乙炔为原料在不同的反应条件下还可以转化成以下化合物。
完成下列各题:
(1)写出实验室制备乙炔的化学方程式_____________________________________
(2)写出制备氯乙烯的化学方程式______________________________________。
(3)乙炔中C原子的杂化方式是____________________。
(4)正四面体烷的核磁共振氢谱图中有___________个峰。
(5)关于乙烯基乙炔分子的说法正确的是:________________
a 、乙烯基乙炔不能使溴的四氯化碳溶液褪色
b 、乙烯基乙炔分子内只含有一种官能团
c 、1mol乙烯基乙炔最多能与3molH2发生加成反应
d 、等物质的量的乙炔与乙烯基乙炔完全燃烧时的耗氧量为1:2
e 、等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同
f 、乙烯基乙炔与正四面体烷互为同分异构体
(6)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:_________
有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答下列问题: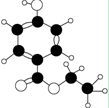
(1)写出A的分子式: ;
(2)A能够发生反应的类型有(填序号): ;
①氧化反应 ②加成反应 ③取代反应 ④消去反应
(3)写出A与烧碱溶液反应的化学方程式:___________________;
(4)下列是一些中草药中所含的有机物: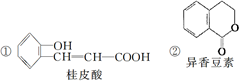
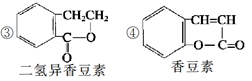
其中互为同分异构体的是(填序号)____________;
能与溴水反应的是(填序号)____________;
(5)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,写出B转化为二氢异香豆素的化学方程式:____________________________________________________;
(6)A的另一种同分异构体C遇FeCl3溶液显紫色;1 mol C可与1 mol NaOH反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,E经消去、酯化两步反应可得香豆素。写出符合上述要求的一种C的结构简式:______________。