(12分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢: 
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。( ,计算结果保留小数点后1位)
,计算结果保留小数点后1位)
卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应,其实质是带负电的原子团(例如OH-等阴离子)取代卤代烃中的卤原子。例如:
CH3CH2CH2Br+OH-(或NaOH) CH3CH2CH2—OH+Br-(或NaBr)
CH3CH2CH2—OH+Br-(或NaBr)
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应______________________________________________________。
(2)碘甲烷跟CH3COONa反应_________________________________________________。
(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3—O—CH2CH3)。_______________。
某芳香族化合物A的分子式为C7H6O2,溶于NaHCO3水溶液,将此溶液加热,能用石蕊试纸检验出有酸性气体产生。
(1)由此推断出A的结构简式为________________________________________________。
(2)写出有关反应的化学方程式:_______________________________________________。
(3)A有_________个属于芳香族化合物的同分异构体,它们的结构简式为____________。
(1)今有A、B、C三种二甲苯;将它们分别进行一硝化反应,得到的产物分子式都是C8H9NO2,但A得到两种产物,B得到三种产物,C只得到一种产物。由此可以判断A、B、C各是下列哪一种结构,请将字母填入结构式后面的括号中。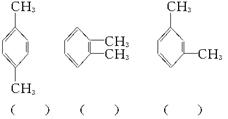
(2)请写出一个化合物的结构简式。它的分子式也是C8H9NO2,分子中有苯环,苯环上有三个取代基,其中之一为羧基,但并非上述二甲苯的硝化产物。请任写一个:______________________。
(1)短周期的元素A、B,A原子最外层电子为a个,次外层电子为b个;B原子M层电子为(a-b)个,L层为(a+b)个。则A为______________,B为______________。
(2)已知X元素L层比Y元素L层少3个电子,Y元素原子核外电子总数比X元素多5个,则X、Y分别为______________、______________。
化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。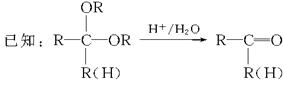

请完成下列问题:
(1)写出下列物质的结构简式:
A:____________,B:____________,C:____________,D:____________。
(2)指出反应②的反应类型________________________。
(3)写出反应③的化学方程式____________________________________________________。
(4)反应④的目的是____________________________________________________________。
(5)化合物D′是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D′在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D′生成E和F的化学方程式:
D′→E:_____________________________________________________________________。
D′→F:____________________________________________________________________。