(1)今有A、B、C三种二甲苯;将它们分别进行一硝化反应,得到的产物分子式都是C8H9NO2,但A得到两种产物,B得到三种产物,C只得到一种产物。由此可以判断A、B、C各是下列哪一种结构,请将字母填入结构式后面的括号中。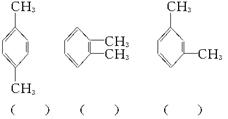
(2)请写出一个化合物的结构简式。它的分子式也是C8H9NO2,分子中有苯环,苯环上有三个取代基,其中之一为羧基,但并非上述二甲苯的硝化产物。请任写一个:______________________。
短周期元素X、Y、Z、W原子序数依次增大。X是形成化合物种类最多的元素,Y是自然界含量最多的元素,Z是同周期中金属性最强的元素,W的负一价离子与Y的某种氢化物分子含有相同的电子数。
(1)元素X、Y、Z按原子半径由大到小的顺序排列为。(用元素符号表示)。
(2)W的单质与水反应的离子方程式为。
(3)化合物A由X、Y、Z三元素共同构成,其浓溶液中通入W的单质时,可产生气体XY2和化合物ZWY3。反应的化学方程式为。
A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系。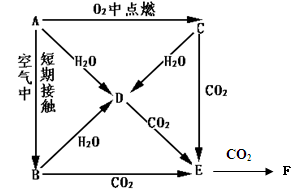
(1) 写出以下物质的化学式:CF
(2) 完成以下离子方程式:
C→D:
D→E:
(3) 等质量的A和B分别投入到等质量且足量的水中,反应后所得溶液溶质质量分数分别为
ω1、ω2,则ω1ω2 (填“>”或“<”或“==”)。
(4) E中混有少量的F,用化学方程式表示除去F的两种方法:
、
(5) 用m g的D来制取纯净的E,写出最简单的实验方法
L、M、Q、R、X代表五种物质,它们都含某种价态的氮元素,各物质中氮元素的化合价只有一种。物质L中氮元素的化合价比物质M中氮元素的化合价低。在一定条件下,它们会有如下的转化关系(未配平)。
Q + HCl M+Cl2+H2O R+L
M+Cl2+H2O R+L X+H2O R+O2
X+H2O R+O2 L+ H2O
L+ H2O
请判断:
(1) 五种物质按氮元素的化合价从高到低的顺序排列是 ,
若五种物质中有一种是硝酸,那么硝酸应该是(用字母表示)
(2) 某同学写出下面不同价态的氮的化合物相互转化关系(未配平),其中你认为一定不能实现的是( )
A.NO+HNO3 N2O3+H2O B.NH3+NO
N2O3+H2O B.NH3+NO HNO2+H2O
HNO2+H2O
C.N2O4+H2O HNO3 +HNO2
HNO3 +HNO2
(1) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
FeSO4 +________ → ________ + ________+________+H2O
(2) 反应物中发生氧化反应的物质是________,被还原的元素是________。
(3) 反应中1 mol氧化剂________(填“得到”或“失去”)________mol 电子。
(4) 请将反应物的化学式及配平后的系数填入下列相应的位置中: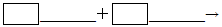
现有m g 某气体,它由四原子分子构成,它的摩尔质量为Mg/mol,则:
(1) 该气体的物质的量为
(2) 该气体所含的原子总数为个
(3) 该气体在标准状况下的体积为
(4) 该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
(5) 该气体溶于水后形成VL溶液,其溶液的物质的量浓度为