(1) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
FeSO4 +________ → ________ + ________+________+H2O
(2) 反应物中发生氧化反应的物质是________,被还原的元素是________。
(3) 反应中1 mol氧化剂________(填“得到”或“失去”)________mol 电子。
(4) 请将反应物的化学式及配平后的系数填入下列相应的位置中: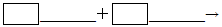
工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
(1)下列装置可用于吸收气体X的是 (填代号)。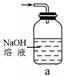



(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为 。
②实验时,依次进行如下操作:组装仪器、 、加装药品、通入气体、 、点燃酒精灯。
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为 。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定剂 EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2-+ 2H+。则CuSO4·5H2O质量分数为________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。
(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
(原创)用以下几种常见有机物填写下列空白:
a.CH4
b.C2H4
c.C6H6
d.C2H5OH
e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是 (用序号表示)。
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为 。
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为 L。
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
104.7 g |
| (澄清石灰水+广口瓶)的质量 |
312.0 g |
318.6 g |
根据实验数据填空:
①假设广口瓶里生成一种正盐,其质量为 g。
②混合气体中C、H两元素的物质的量之比为 。
③若混合气体是由CH4和C2H4组成,则二者的体积比为 。
(原创)铜及其化合物在工农业生产中都有着广泛应用。
(1)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2、Cu2S+O2=2Cu+SO2。当有1molCu生成,则第一个反应中转移电子 mol。
(2)某种处理火法炼铜中SO2废气的工艺流程如下图所示。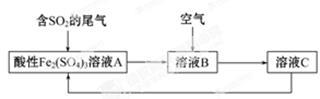
①溶液A中发生的反应为 。
②由流程图可推知Fe3+、O2、SO42-的氧化性由强到弱的顺序为 。
(3)已知反应:3Cu+2NO3-+xH+=3Cu2++2R+yH2O。则
①反应中的x= 。
②反应产物R的化学式为 。
③参加反应的Cu和消耗的HNO3物质的量之比为 。
下图是化学实验中常用的几种装置。
请回答下列问题: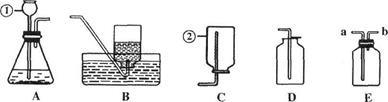
(1)指出有编号的仪器名称:① ,② 。
(2)利用上述A、D装置的组合可以制取的一种气体是 ,写出实验室制取该气体的化学反应方程式 。
(3)若用E装置收集该气体,则气体应从 (选“a”或“b”)导入;若用E装置干燥生成的气体,E中盛放的液体试剂是 。
(4)在实验室如使用碳酸钠与稀盐酸、选用A装置制二氧化碳,需要对A装置进行的改进是 。