臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+Os(g)=3Ag2O(s);
△H= 一235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为 。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。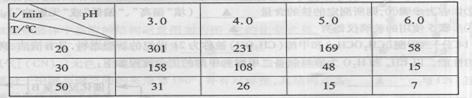
pH增大能加速O3分解,表明对O3分解起催化作用的是 。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为 ;阴极附近的氧气则生成过氧化氢,其电极反应式为 。
(4)为测定大气中臭氧(03)含量,将0℃、1.01 × 105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol·L。的Na2S2O2溶液进行滴定恰好到达终点。
①O3与Ⅺ溶液反应生成两种单质,则反应的化学方程式 。
②空气中臭氧的体积分数为 。
(已知:2Na2S2+12=Na2S406+2NaI)
DAP-A树脂是一种优良的热固性树脂,
被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥,对环境及人员无损害,性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。这种材料可采用下列路线合成: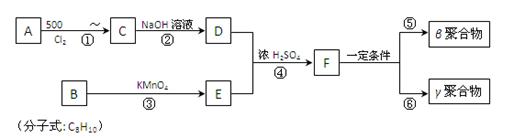

试回答下列问题:
(1)A的名称是_______________。
(2)在①~④的反应中属于取代反应的是。
(3)B的结构简式是______________________,B苯环上的一氯代物有种。
(4)写出反应②、⑤的化学方程式:
② 。
⑤ 。
(5)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是___________和_____________。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为.
(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属②锌(Zn)可以与NaOH溶液反应生成H2③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
●提出假设:(1)假设①:该混合金属粉末中除镁外还含有________元素假设②:该混合金属粉末中除镁外还含有________元素假设③:该混合金属粉末中除镁外还含有铝、锌元素●实验探究:甲同学基于假设③设计实验方案如下: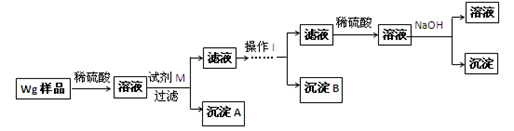
乙同学同样基于假设3设计另一实验方案如下:
(2)试剂M是________________;沉淀B是。
(3)丙同学认为乙同学的方案比甲同学的好,理由是。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入,直至生成的沉淀刚好溶解,再加入足量的。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。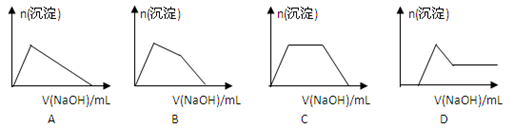
合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为: N2(g)+3H2(g) 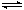 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) 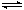 CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,
体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,
水蒸气的总转化率α (H2O)。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1573K(填“>”、“<”或“=”)。
| T/K |
T1 |
573 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)。 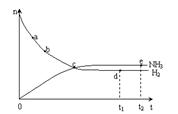
| A.c点表示n(NH3)和n (H2)相等 |
| B.c点表示NH3生成速率与NH3分解速率相同 |
| C.e点和d点时反应的平衡常数相同 |
| D.c点时正反应速率大于逆反应速率 |
(4)用NO2溶于水制硝酸:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
。
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
负极的电极反应式:;
正极的电极反应式: 。
。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,问通过导线的电子数;( 表示阿氏常数)
表示阿氏常数)