将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H 2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。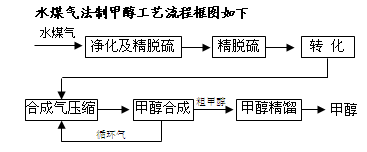
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)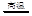 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的 措施是 ;(填字母代号)
措施是 ;(填字母代号)
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4[ |
①比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol-1·(Lmin)-1。
(3)生产过程中,合成气要进行循环,其目的是  。
。
用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量57.3 kJ;
(6)可逆反应:aA(气)+bB(气) cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: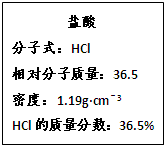
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
现有失去标签的CaCl2.、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A+B |
无现象 |
| ② |
B+D |
有气体放出 |
| ③ |
C+B |
有沉淀生成 |
| ④ |
A+D |
有沉淀生成 |
根据上述实验填空:
(1)A、B、C三瓶溶液分别是(用化学式表示):__________、____________、_____________。
(2)写出B和D反应的离子方程式:___________________________________________。
(3)说明A和B不发生反应的理由:___________________________________________。
鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选作鉴别的试剂有(填编号,可多选)_________。
A.BaCl2溶液 B.Mg(NO3)2溶液 C.Na2CO3溶液
②鉴别反应的离子方程式:_________________________。
(2)饱和碳酸钠溶液、澄清石灰水
①可选用鉴别的试剂有(填编号,可多选)____。
a.盐酸 b.NaCI c.硝酸 d.BaCl2溶液
②依次写出鉴别中有明显现象的反应的离子方程式:________________________________。