用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量 1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值 110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量 57.3 kJ;
(6)可逆反应:aA(气)+bB(气) cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
木炭与浓硫酸反应可表示为:C +2H2SO4(浓)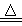 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(1)木炭作(填“氧化剂”或“还原剂”),硫酸(填“被氧化”或“被还原”)。
(2)若消耗了1 mol H2SO4,则生成mol SO2。
从海水中提取的粗盐含有泥沙和Ca2+、Mg2+、SO42-等离子,为制备精盐可使用以下试剂:①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液等。
(1)加入试剂的合理顺序是(填选项)。
a.①②③b.③①②c.②①③d.③②①
(2)加入过量Na2CO3溶液的作用是。
(3)向最后过滤所得溶液中滴加至无气泡产生,再经蒸发结晶得到食盐晶体。
按下图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为,B池为;
(2)锌极为极,铜极上的电极反应式为,
石墨棒C1为极,电极反应式为,
石墨棒C2附近产生的现象为;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为g(“增加”或“减少”)。
工业上为了处理有Cr2O72—的酸性废水,采用下面的处理方法:往工业废水里加入适量的NaCl,以Fe为电极进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中Cr3+的浓度若低于10—5mol/L可符合排放标准。回答下列问题:
(1)电解时阳极上发生的电极反应式:;
(2)写出Cr2O72—变为Cr3+的离子方程式;
(3)工业废水由酸性变为碱性的原因是;
(4)已知室温下Cr(OH)3的KSP=1×10—32,则该温度下符合排放标准的溶液的最低pH为。
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,所需溶液的pH分别为6.4、6.4、3.7。现由含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其配制成水溶液,然后按图示步骤进行提纯: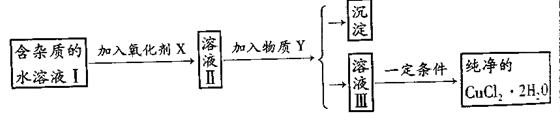
请回答下列问题:
(1)本实验最适合的氧化剂是()(填下面的序号)
| A.K2Cr2O7 | B.NaClO | C.H2O2 | D.KMnO4 |
(2)物质Y是;(用化学式表示)
(3)本实验用碱沉淀法能否达到目的?;原因是;
(4)除去Fe3+的原理是;