某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有较多的SiO2、Al2O3及少量的不溶于酸的杂质)提取Fe2O3。操作过程如下:

(1)(Ⅰ)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(2)写出沉淀A中含量最多的物质与NaOH溶液反应的离子方程式: ;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成 色。反应的离子方程式为: ,滤液Y中的阴离子有 种;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式 ;
实验室为验证同主族元素性质递变规律,准备了如下药品:
①AgNO3(aq)②稀HNO3③Br2(aq)④I2(aq)⑤NaOH(aq)⑥NaCl(aq)⑦NaBr(aq)⑧H2O⑨Na⑩镁条⑪铝条⑫K
(1)你准备选用的药品是(用编号表示)______。
(2)你所做的实验是什么(用方程式表示)?判断依据是什么?
X、Y、Q、R是同一短周期的元素。已知:
(1)X的最高正价绝对值是最低负价绝对值的3倍,其气态氢化物与最高价氧化物的相对分子质量之比是1∶2.35。
(2)Y和Q的气态氢化物分子组成分别是YH4和QH3。R的氢化物化学式为RH2,但常温时不是气态的。
(3)另有一种元素E,其阳离子和X的阴离子带有等量的相反电荷,且核外电子数相同。请指出X、Y、Q、R、E各是什么元素以及它们在元素周期表中的位置。
将某文献资料上记载的相对原子质量数据摘录如下: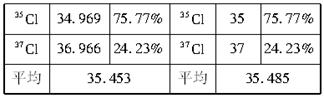
试完成下列问题:
(1)34.969是表示_____________________。
(2)35.453是表示_____________________。
(3)35是表示_________________________。
(4)35.485是表示_____________________。
2.36 g H2O和100 g D2O所含的氧原子数之比为______;分别与足量钠反应后,在标准状况下放出气体的体积比为_____;质量比为_____。
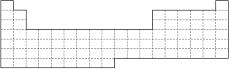
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的________族。
(3)第四周期有A、B、C、D四种元素,其最外层电子数依次为1、2、2、7,其原子序数按A、B、C、D的顺序增大,又已知A、B的次外层电子数为8,C、D的次外层电子数为18。请将A、B、C、D用元素符号填写在上面周期表中的对应位置上。