胃酸过多是常见的胃病,下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;④遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有引起胃溃疡穿孔的危险;(6)焰色反应为黄色。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是______________(填化学式,下同);乙中含有的主要化学成分是______________。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式 ___
(3)试写出乙溶于NaOH溶液的离子方程式 。
A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系: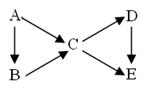
(1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。
①Na②N2 ③C④S
(2)若五种物质的焰色反应均为黄色,其中C、D、E的水溶液
均显碱性,且等浓度时碱性C>D>E,B可做生氧剂, 则B中含有的化学键类型为__________________;
则B中含有的化学键类型为__________________;
A转化成C的离子方程式为: ________________________________,
D转化成E的离子方程式为____________________ ___________________。
___________________。
(3)若常温下B、C、D均为气体,且B气体能使湿润的红色石蕊试纸变蓝
①在工业上生产B气体时为了加快反应速率应选择的条件是______________,其中能提高反应物的转化率的条件是___________。
②C、D是汽车尾气中的有害成分,用NaOH溶液吸收可消除污染,反应的化学方程式为__________________________________。
铁与HNO3 作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。
作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析下图,回答有关问题。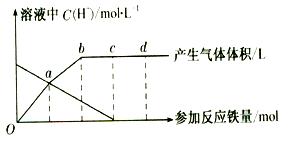
假设曲线的各段内只有一种还原产物,。
(1)0点到a点的还原产物是。
(2)a点到b点的还原产物是____,其原因是。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是。
( 6)c点和d点参加反应的铁的物质的量之比是。
6)c点和d点参加反应的铁的物质的量之比是。
某溶液仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
| 阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
OH- CO32- Cl- NO3- SO42 - - |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变;
请推断:
(1)原溶液中含有阳离子:;含有阴离子: ;
;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式:;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。
X、Y、Z三种常见的短周期元素可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)写出X、Y、Z三种元素的符号和名称:;
(2)分析Z2Y2中含有的化学键类型:;
(3)写出Z2Y2与二氧化碳反应的方程式:;
(4)用电子式表示X和Z两元素形成化合物的过程:。
在第三周期元素及其单质和化合物中,原子半径最小的元素是________;氧化性最强的单质是________,还原性最强的单质是________;金属的熔沸点最低的单质是________;最高价氧化物对应水化物中,最强的酸是________,最强的碱是_______;形成的两性化合物有________、________。