A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系: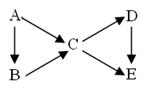
(1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。
①Na ②N2 ③C ④S
(2)若五种物质的焰色反应均为黄色,其中C、D、E的水溶液
均显碱性,且等浓度时碱性C>D>E,B可做生氧剂, 则B中含有的化学键类型为__________________;
则B中含有的化学键类型为__________________;
A转化成C的离子方程式为: ________________________________,
D转化成E的离子方程式为____________________ ___________________。
___________________。
(3)若常温下B、C、D均为气体,且B气体能使湿润的红色石蕊试纸变蓝
①在工业上生产B气体时为了加快反应速率应选择的条件是______________,其中能提高反应物的转化率的条件是___________。
②C、D是汽车尾气中的有害成分,用NaOH溶液吸收可消除污染,反应的化学方程式为__________________________________。
天然有机产物A是芳香族化合物,其中碳的质量分数是氧质量分数的2倍,完全燃烧后仅得到物质的量之比为2︰1的CO2和H2O。A具有极弱的酸性,且能与HI作用得到B,结构分子显示A分子内无相同官能团而B分子内对位有相同官能团,A分子内无氢键而B分子内有氢键。
已知 R–O–R′ +HI→R–O–H + R′–I
(1 ) A的化学式为
(2)写出A、B的结构简式(B中标出氢键),
(3)与A具有相同官能团的位置异构体有种(含自身)
与B具有相同官能团的位置异构体有种(含自身)
(4) A另有一种异构体C,无酸性,但能与NaOH以1︰3反应。
写出C与NaOH反应的化学方程式。
在沥青蒸气里含有多种稠环芳香烃,如下图所示A、B、C ……,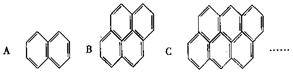
(1)该系列化合物的通式为,
(2)该系列化合物中碳的质量分数最大值为,
(3)其中A的二氯取代可能结构有种.
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为,乙的电子式为。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,甲的电子式,乙的化学式为。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:,Y原子基态电子排布式为。
氰酸(化学式:HOCN)是一种有挥发性和腐蚀性的液体,在水中立刻发生如下反应形成盐X(俗名碳铵):HOCN + 2H2O → X。
(1). 在上述反应所涉及的各元素中,半径最大的元素原子在周期表中的位置是___________,该原子核外电子共占据_______个轨道。
(2). X所含阳离子的电子式是________;已知25℃时0.1mol/L X溶液pH =7.8,用离子方程式表示原因:______________________。
(3). 能说明氮元素的非金属性比碳元素强的事实是_________(选填编号)。
a. 共用电子对偏向:H-N>H-C b. 氧化性:NO2>CO2
c. 酸性:HNO3>H2CO3 d. 沸点:NH3>CH4
(4). 据测定,氰酸有两种结构,一种分子内含有叁键,称为正氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出正氰酸和异氰酸的结构式:_______________、______________。
(10分)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液的pH=________;
(2)HA的电离平衡常数K=________;
(3)升高温度时,K将______(填“增大”、“减小”或“不变”),pH将______(填“增大”、“减小”或“不变”);
(4)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。