(12分)(2011·银川高二检测)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________。(填ΔH1、ΔH2和ΔH3等)
| A.2H2(g)+O2(g)===2H2O(l) ΔH1 |
| B.C(s)+O2(g)===CO(g) ΔH2 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3 |
| D.C(s)+O2(g)===CO2(g) ΔH4 |
E.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH7
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 |
P—P |
P—O |
O===O |
P===O |
| 键能kJ/mol |
197 |
360 |
499 |
x |
已知白磷(P4)的燃烧热为2 378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=________。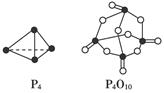
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: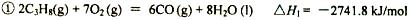

(1)反应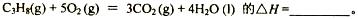
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.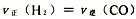
c.混合气体的平均相对分子质.量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=。
③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的正极电极反应式为。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。
(12分)V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
(1)W的原子结构示意图为;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种
化合物,这两种化合物均由两种元素组成。其反应的化学方程
式为;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:
若E为白色沉淀,则E物质的化学式为;
(4)含同价态X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp[X(OH)n]
(填“>”或 “<”) ksp[Z(OH)n];
(5)联氨(N2H4)也叫做肼,是重要的火箭燃料。以次氯酸钠溶液氧化M,能获得肼的稀溶液。其反应的离子化学方程式为。同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则ab(填“>"或“<”或“=”)。
(1)现有下列状态的物质①干冰 ②NaCl晶体 ③氨水 ④醋酸 ⑤酒精水溶液 ⑥铜 ⑦熔融的KOH⑧蔗糖,其中属于电解质的是,属于非电解质的是,能导电的是, 其中能导电的电解质的电离方程式是。
(2)含有下列离子的五种溶液 ①Ag+ ②Mg2+③Fe2+④Al3+ ⑤Fe3+ 试回答下列问题:
①既能被氧化又能被还原的离子是____________(填离子符号,下同)
②能用来鉴别Cl–存在的离子是___________
③加入过量NaOH溶液无沉淀的是_____________
④加铁粉溶液质量增重的是_________,溶液质量减轻的___________
⑤遇KSCN溶液呈红色的是_________________________
(3)按要求写出下列方程式:
① 醋酸电离的电离方程式: ,
② 小苏打治疗胃酸过多的离子方程式:。
③ 向FeSO4溶液中加入NaOH溶液,现象是
有关化学方程式为,
某课外小组模拟工业流程,设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO 的化学方程式:______________;___________________。
的化学方程式:______________;___________________。
(2)连接好该装置后,首先进行的操作是:_____________________。
(3)通入的气体a是______________(填化学式),通入a的目的是:___________。
(4)盛有Na CO
CO 溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
_______NO +_______Na
+_______Na CO
CO +_______H
+_______H O=NaNO
O=NaNO +_______+_______NaHCO
+_______+_______NaHCO (完成此方程式)
(完成此方程式)
(5)用N O
O 代替NO
代替NO 与水和a气体反应可生成硝酸,此反应的化学方程式是:
与水和a气体反应可生成硝酸,此反应的化学方程式是:
____________________________________。
(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,这是因为_______________,反应的离子方程式是____________________。
(2)在碘和淀粉形成的蓝色溶液中通入SO 气体,发现蓝色逐渐消失,这是因为
气体,发现蓝色逐渐消失,这是因为
_____________________,反应的离子方程式是______________________。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I 、SO
、SO 按还原性由强到弱顺序排列为____________________。
按还原性由强到弱顺序排列为____________________。