丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: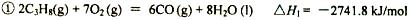

(1)反应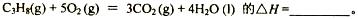
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.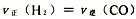
c.混合气体的平均相对分子质.量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数___ _(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由__ __极移向___ _极(填“正”或“负”);电池的正极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的新型替代能源。按照我国的国家标准,乙醇汽油是用90%的普通汽油与10%的乙醇调和而成。
(1)由粮食或各种植物纤维可得到葡萄糖,写出葡萄糖制得乙醇的化学方程式:。
(2)在常温常压下,1gC2H5OH完全燃烧生成CO2和液态H2O时放出29.71 kJ热量,表示该反应的热化学方程式为。
(3)下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
①加入乙醇的Pt电极的电极反应式为_________________________。
②在工作过程中,乙池中两电极均收集到标准状况下224mL气体时,甲池中理论上消耗氧气的体积为mL(标准状况下);若此时乙池溶液体积为200mL,则乙池中溶液的pH为。
③若要使②中乙池的溶液完全恢复到起始状态,可向乙池中加入(填代号)
| A.0.01molCu |
| B.0.01molCuO |
| C.0.01molCu(OH)2 |
| D.0.01molCuCO3 |
E.0.01molCuSO4
F.0.005molCu2(OH)2CO3
将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
| 压强/MPa 体积分数/% 温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
54.0 |
a |
b |
| 915 |
c |
75.0 |
d |
| 1000 |
e |
f |
83.0 |
(1)915℃、2.0MPa时E的转化率为。
(2)该反应的△S0(填“>”、“<”或“=”,下同),bf。
(3)平衡常数K(1000℃)K(810℃) ,理由是。
(4)对于上述反应,下列说法正确的是(填序号)。
①混合气体的密度不再变化,反应达到平衡
②该反应的正反应为放热反应
③增大F的量,单位体积活化分子数增大,化学反应速率加快
④恒温恒容条件下通入惰性气体,平衡不移动
⑤恒温恒压条件下通入惰性气体,化学反应速率加快
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题以此粉末为原料,资源回收的工艺流程如下:
(1)写出第①步反应的离子方程式。
(2)洗涤滤渣B的目的是为了除去____(填离子符号),检验该离子是否洗净的方法是。
(3)写出第③步反应的化学方程式_____________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后,用0.1000mol/LFeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。
某混合溶液中可能大量含有的离子如下表所示:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。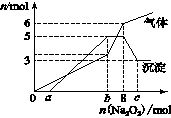
(1)该溶液中一定含有的阳离子是______________,其
对应物质的量浓度之比为________,溶液中一定不
存在的阴离子是_____________。
(2)请写出沉淀减少的离子方程式_____________________。
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
已知:(I)R1-CH=CH-R2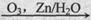 R1-CHO+R2-CHO
R1-CHO+R2-CHO
(Ⅱ)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:
(1)F的名称是,C中含有的官能团的名称是,H的结构简式为.
(2)B的核磁共振氢谱图上峰的个数是.
(3)③的反应条件是.
(4)写出下列反应类型:⑥,⑨.
(5)写出⑩反应的化学方程式.C与足量银氨溶液反应的化学方程式.
(6)1mol有机物B与足量CH3C18OOH在一定条件下完全反应时,生成的有机物的结构简式可能为(如有18O请标示).