(18分)(2011·黄岗中学高二质检)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。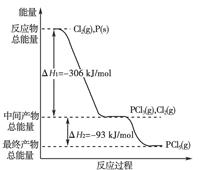
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是__________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
(10分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有性,氧化产物是(写化学式)。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了mol H2SO4,生成L SO2(标准状况)气体。
(3)Cu与SO2的还原性由强到弱的顺序为:CuSO2(填“>”、“<”或“=”)。
实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们。根据有关操作及所加试剂填空。

A B C
(1)A试管中的现象:溶液显紫色;另取该溶液滴入Na2CO3溶液中,无明显现象。
试推断试剂X为。
(2)B试管中的现象:溶液显蓝色;另取该溶液滴入Na2CO3溶液中的现象为 ___
有关反应的离子方程式为 __________。
(3)C试管中的现象:有气泡产生,有关反应的离子方程式为 _________;
另取该溶液滴入试剂X, 则溶液显 _____________。
某同学用18 mol/L的浓硫酸配制200mL 0.9mol/L的稀硫酸,并进行有关实验。请回答下列问题:
(1)需要量取浓硫酸 mL(准确到小数点后一位)。
(2)配制该稀硫酸时使用的仪器除量筒、烧杯、200mL容量瓶外,还必须用到的仪器有 、 等。
(3)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是( )
| A.可以按此建议改进,便于使用容量瓶 |
| B.不能按此建议改进,因为会降低容量瓶的精确度 |
| C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上 |
| D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
(4)在配制过程中,下列因素对所配制的稀硫酸的物质的量浓度有何影响?
若容量瓶未干燥即用来配制溶液,则所得溶液浓度 0.9 mol·L-1(填“大于”、“等于”或“小于”,下同);若定容时俯视刻度线,则所得溶液浓度 0.9 mol·L-1。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.结晶法 | D.分液法 |
E.渗析法 F.蒸馏法 G.过滤法
(1)___________分离饱和食盐水和沙子的混合物;
(2)___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)___________分离水和煤油的混合物;
(4)___________分离水和酒精;
(5)___________分离溴水中的溴和水。
在容积为V L的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。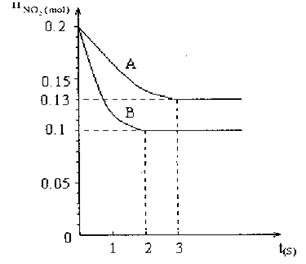
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.压强不同 C.温度不同
(2)写出该反应的化学平衡常数K的表达式,并比较K800℃K850℃(填>、<或=)。
(3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2=。
(4)能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变