NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)NH3与氧气反应可生成NO,化学方程式为 ;若参加反应的NH3为6 mol,则反应中转移了__________mol电子。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,化学方程式为 。
(4)将0.05molNO和0.03molO2气体混合再以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) 。
2,3-二氧呋喃是抗肿瘤药物的中间体,四氢呋喃是常用溶剂,它们可以通过下列反应流程来合成: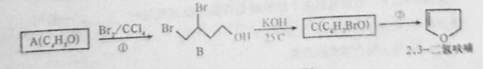
已知: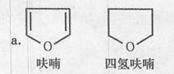
b.在碱存在的条件下,卤代烃可与酵发生如下反应:
R—X+R′—OH→R—O—R′+HX
请填写下列空白:
(1)化合物B的名称为;反应①的反应类型是;反应②的反应条件是。
(2)写出结构简式:A为;C为;A与乙酸反应生成的酯为。
(3)工业上可由二元醇D( C4H10O2)在一定条件下脱水制得四氢呋喃,该反应的化学方程式为。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式。
I.没有支链,且一元取代产物只有两种。
Ⅱ.不能与银氨溶液发生银镜反应。
Ⅲ.核磁共振氢谱图有2个峰,其面积之比为1:3。
(5)2,3—二氢呋喃在一定的条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化?。
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是(填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为,它属于(填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是。
(4)F的基态原子核外电子排布式是。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能(填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为。已知该晶体的密度为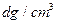 ,其摩尔质量为
,其摩尔质量为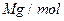 ,则该晶胞的体积是。(请列出算式)
,则该晶胞的体积是。(请列出算式)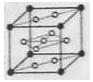
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1)C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为。
(2)为探究反应6H2(g)+2CO2(g)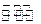 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
根据表中实验数据分析:
①该反应的正反应为(填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有(写出一条即可)。
(3)一定条件下,将3 mol H2和1mol CO2气态混合物充入2L密闭容器中,发生如下反应:3H2(g)+CO2(g)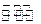 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是。
A.该反应的平衡常数表达式为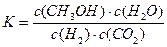 |
| B.CO2的平衡转化率为40% |
| C.2min内H2的平均反应速率为0.3mol/(L·min) |
| D.该反应达到平衡状态的标志是混合气体的密度不发生改变 |
(4)右图是甲烷燃料电池的工作原理示意图,电解质溶液为KOH溶液。则负极室通入的气体是(填“甲烷”或“氧气”);正极室电极上发生的电极反应是;其电池的总反应为。比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是能量转化效率高,其次是。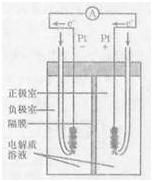
某固体混合物可能由SiO2、Fe2O3、A12O3、Na2SO3、Na2CO3中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示: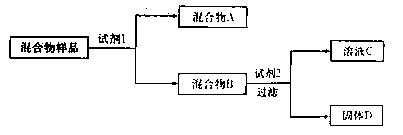
请回答下列问题:
(1)若试剂1是稀硫酸,试剂2是氢氧化钠溶液。在混合物样品中加以足量的稀硫酸后,固体全部溶解,得到混合气体A和澄清溶液B,在B中滴加过量氢氧化钠溶液时,先有沉淀生成,后沉淀部分溶解。则该混合物样品中一定不含的物质是;固体D的化学式为;检验混合物B中含有Fe3+所选用的试剂是;证明混合气体A中含有CO2的实验方法是。
(2)若试剂1是水,试剂2是氢氧化钠溶液(过量)。在混合物样品中加足量的水后过滤,混合物B是滤渣,试推断:固体D的化学式为;检验溶液C中是否含有SiO32—的实验方法是。
某混合物A ,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中 对于溶液和沉淀的分离采取的方法是。
对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B;沉淀C;沉淀D;溶液E。
(3)写出①、③、④三个反应方程式和②离子方程式。
① ____;② _____;
③ ____ ;④ ___。