已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为 。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为 ,它属于 (填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是 。
(4)F的基态原子核外电子排布式是 。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能 (填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为 。已知该晶体的密度为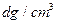 ,其摩尔质量为
,其摩尔质量为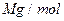 ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)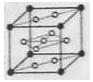
写出下列反应化学方程式:
⑴二氧化氮和水反应:;
⑵碳和浓硝酸共热:;
⑶铜和稀硝酸反应:;
某同学设计了一种电解法制取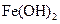 的实验装置(如
的实验装置(如 图)。玻璃管内的电解液为
图)。玻璃管内的电解液为 溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
(1)写出A电极的电极反应式_________;B电极的电极反应式__________;
(2)若电解改用 溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用
溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用 溶液作电解液时白色沉淀能保持较长时间的原因_____________。
溶液作电解液时白色沉淀能保持较长时间的原因_____________。
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的_____极,发生的电极反应为_________;
X电极上发生的电极反应为_____________________;
(3)外电路中的电子是从_______电极流向________电极。(填电极材料名称)
(1 )在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为:。
)在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为:。
(2)用离子方程式表示下列化学变化:
①电解氯化钠溶液__________________________________ __
__
②电解硝酸银溶液_____________________________________
(12分)已知醛在一定条件下可以发生如下转化: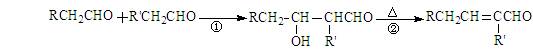
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题: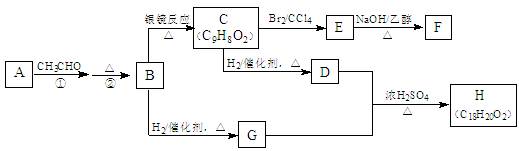
(1)A、B的结构简式为:A__________________,B_________________。
(2)G、D反应生成H的化学方程式是:___________________________。
(3)一定条件下,能够与1mol F发生反应的H2的最大用量是:_______ mol。
(4)G有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的同分异构体的结构简式为(不含G):_______________、_________________、__________________、__________________。