已知AgI为黄色沉淀,AgCl为白色沉淀。25℃时, AgI饱和溶液中c(Ag+)为1.22×10-8 mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L- 1的混合溶液中,滴加8mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是( )
1的混合溶液中,滴加8mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是( )
| A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀 |
下列关于物质的性质与用途的说法中不正确的是
| A.氧化铝的熔点很高,因此可用做耐火材料 |
| B.某些金属氧化物灼烧时有特殊的颜色,因此可用于制造烟花 |
| C.氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
| D.氯气具有强氧化性,因此可用于漂白有色布料 |
科学工作者发现另一种“足球分子”N60,它的结构与C60相似。下列说法正确的是
| A.N60和C60互为同素异形体 | B.N60是一种新型化合物 |
| C.N60和N2是同系物 | D.N60和14N都是氮的同系物 |
化学与环境保护密切相关,下列叙述正确的是
| A.绿色化学的核心是应用化学原理对环境污染进行治理 |
| B.煤经气化和液化两个物理变化过程,可变为清洁燃料 |
| C.PM2.5(2.5微米以下的颗粒物)的污染主要来自化石燃料的燃烧 |
| D.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 |
25℃时,浓度均为0.1mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
| A.在0.1mol/LBA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) |
| B.若将0.1mol/LBOH溶液稀释至0.001mol/L,则溶液的pH=9 |
| C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) |
| D.若将上述两溶液按体积比1:2混合,则混合液中:c(B+)>c(A-)>c(BOH)>c(OH-)>c(H+) |
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是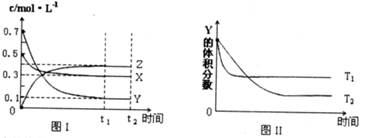
| A.该反应的热化学方程式为:ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通人稀有气体,平衡向正反应方向移动 |