(11分) 苏丹红一号(sudan Ⅰ)是一种偶氮染料,不能作为食品添加剂使用。 它是由苯胺和2-萘酚为主要原料制备的,它们的结构简式如下所示:
它是由苯胺和2-萘酚为主要原料制备的,它们的结构简式如下所示:
(1)苏丹红一号的化学式(分子式)为_________。
(2)在下面化合物(A)~(D)中,与2-萘酚互为同分异构体的有(填字母代号)______。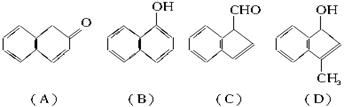
(3)上述化合物(C)含有的官能团是______________。
(4)在适当的条件下,2-萘酚经反应可得到芳香化合物E(C8H6O4),1 mol E与足量的碳酸氢钠反应可放出44.8 L CO2 (标准状况), E的结构简式为 。
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是____________________,反应类型 是________________。
是________________。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质。从铝土矿中提炼Al2O3的流程如下:
回答下列问题:
(1)写出反应1的化学方程式;
(2)滤液Ⅰ中加入CaO生成的沉淀是,反应2的离子方程式为;
(3)电解制铝的化学方程式是,以石墨为电极,阳极产生的混合气体的成分是。
硫醇-烯具有反应过程相对简单、反应过程可控等优点,成为近年来有机合成的研究热点之一,如反应①:
(1)化合物I的分子式为______________,反应①的反应类型为______________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为______________。
(3)化合物Ⅲ的氧化产物化合物Ⅳ能发生银镜反应,则Ⅲ的结构简式为_________。化合物Ⅳ与新制Cu(OH)2反应的化学方程式____________________________。
(4)化合物Ⅲ的一种同分异构体Ⅴ有如下特征:a.含有苯环,且苯环上有两个取代基;b.能与FeCl3溶液发生显色反应;c.核磁共振氢谱显示存在5组峰,峰面积之比为1∶1∶2∶2∶6。化合物Ⅴ的结构简式为____________。
化合物M是一种治疗心脏病药物的中间体。以A为原料的工业合成路线如下图所示。己知:RONa+R′Cl→ROR′+NaCl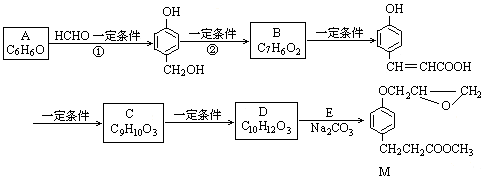
根据题意完成下列填空:
(1)写出反应类型。反应①反应②
(2)写出结构简式。AC
(3)写出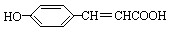 的邻位异构体分子内脱水产物香豆素的结构简式。
的邻位异构体分子内脱水产物香豆素的结构简式。
(4)由C生成D的另一个反应物是,反应条件是。
(5)写出由D生成M 的化学反应方程式。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答以下问题:
(1)Q的原子结构示意图为。
(2)Y元素的单质能发生如图所示的转化,则Y元素为(用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是(用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为QW(填“>”、“<”) ;下列表述中证明这一事实的是。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c. W的原子序数大
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)、CO(g)和CH3OH(1)的燃烧热△H分别为-285.8 kJ .
.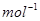 、一283.0 kJ
、一283.0 kJ 和一726.5.kJ
和一726.5.kJ 。请回答下列问题:
。请回答下列问题:
(1)用太阳能分解10mol H2O(1)消耗的能量是________kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
__________________________________________________________________________.
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,
考查温度对反应的影响,实验结果如下图所示(注: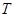 、
、 均大于300℃):
均大于300℃):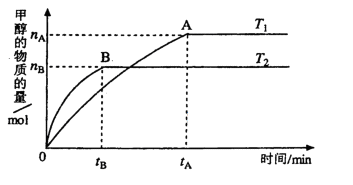
下列说法正确的是_______________(填序号)
①温度为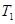 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为: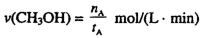
②该反应在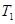 时的平衡常数比
时的平衡常数比 时的小
时的小
③该反应为放热反应
④处于A点的反应体系的温度从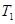 变到
变到 ,达到平衡时
,达到平衡时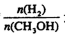 增大
增大
(4)在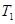 温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为___________________;正极的反应式为_____________________________________.理想状态下,该燃料电池消耗lmol甲醇所能产生的最大电能为701.8kJ,则该燃料电池的理论效率为_______________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。