海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是_________________。(用序号填一种合理组合)。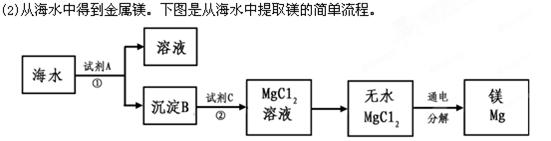 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
由无水MgCl2制取Mg的化学方程式为_____________________________________。海
水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:___________________________________________________________。
(10分)(1)用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
①光导纤维的主要成分是;
②目前应用最多的太阳能电池的光电转化材料是。
(2)氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取。粉末状Si3N4对空气和水都不稳定。但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到对水不稳定的Mg3N2。
①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式:;
②在Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理的过程中,发生反应,反应过程中有Mg3N2生成。其化学方程式为:;
③氮化硅Si3N4是一种高温结构材料,其优点是(只要求写出二种)。
、
(8分)某工厂排出的废水中含氯气,为了除去废水中游离态氯,而且使废水变为中性,有人提出如图所示方案。在废水排出管的A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液。
试写出:(1)A、B处应加入的物质的化学式为______________,_______________。
(2)A、B处反应离子方程式:
A:_________________________。B:_________________。
已知在催化剂存在条件下,能发生如下反应:
CO + H2O(g)  H2 + CO2 + Q
H2 + CO2 + Q
(1)在5 L盛有固体催化剂(其体积可忽略不计)的密闭容器中,通入反应物,10 s后,生成了氢气0.2 g,则此10 s内CO的平均反应速率为v(CO) = _____0.002 mol/Ls______。
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是__BC___
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1 : 1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:
A.在第20 s时将容器体积缩小至 B.在第20 s时,向容器中注入少量的
原来的一半后压强变化图 CO气体后正逆反应速率变化图
合成氨工业中选择20MP~50MP的压强,而没有选择更高的压强,理由是;硫酸工业中选择475℃的温度,而不是选择常温,理由是。在吸收塔中三氧化硫的吸收剂是,选择该吸收剂的优点是
现有①铁片②NaNO3③NH3·H2O ④FeCl3⑤酒精⑥H2S其中属于电解质的是(填写序号),属于非电解质的是,属于强电解质的是,属于弱电解质的是。写出其中可发生水解的物质的水解离子方程式。