下列图示与对应的叙述相符的是 ( )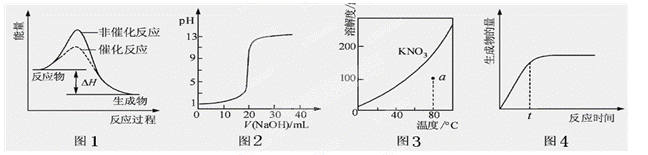
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
关于蛋白质的叙述错误的是( )
| A.浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
| B.蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 |
| C.蛋白质水解的最终产物是氨基酸 |
| D.高温灭菌的原理是加热后使蛋白质变性,从而使细菌死亡 |
某淀粉的相对分子质量为162 000,由此推知,此种淀粉的分子可以水解成葡萄糖的分子数为( )
| A.450 | B.500 |
| C.900 | D.1 000 |
下列有机物在酸性条件下发生水解,生成相对分子质量相等的两种不同的有机物,则该有机物可能是( )
| A.蔗糖 | B.麦芽糖 |
| C.甲酸乙酯 | D.丙酸乙酯 |
下列物质中,在一定条件下既能发生银镜反应,又能发生水解反应的是( )
| A.甲酸甲酯 | B.蔗糖 |
| C.葡萄糖 | D.麦芽糖 |
近几年一种新型的甜味剂——木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者的优点.木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为
CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是( )
| A.木糖醇与葡萄糖、果糖等一样是属于多羟基醛或酮,是一种单糖 |
| B.已知木糖醇的溶解度随着温度升高而增大,说明木糖醇的溶解过程是一个吸热过程 |
| C.木糖醇是一种五元醇 |
| D.木糖醇是一种无糖型植物甜味剂 |