有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、CO32—、SO42—,现取三份100.00ml溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.896L(标准状态下)。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据实验回答下列问题:
(1)判断K+、Cl-是否存在?K+ , Cl- (填下列序号)
A.一定存在 B.可能存在 C.一定不存在
(2)原溶液中,肯定存在的各离子的物质的量浓度分别为多少?
下列实验过程和过程中涉及的离子反应方程式肯定正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2+ + Cl2 2Fe3+ + 2Cl- 2Fe3+ + 2Cl- |
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO + Br2 CH2Br-CHBr-CHO CH2Br-CHBr-CHO |
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2+ + 2OH-+ NH4+ + H+ + SO42- BaSO4↓ + NH3·H2O + H2O BaSO4↓ + NH3·H2O + H2O |
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2 + 4Fe2+ + 6H2O 4Fe(OH)3 ↓+ 8Na+ + O2↑ 4Fe(OH)3 ↓+ 8Na+ + O2↑ |
从某些性质看,NH3和H2O,NH4+和H3O+,OH-和NH2-,N3-和O2-两两相当,据此判断下列反应方程式正确的是
①2Na + 2NH3 2NaNH2 + H2↑ ②CaO + 2NH4Cl
2NaNH2 + H2↑ ②CaO + 2NH4Cl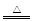 CaCl2 + 2NH3↑+ H2O
CaCl2 + 2NH3↑+ H2O
③3Mg(NH2)2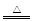 Mg3N2 + 4NH3↑ ④NH4Cl + NaNH2
Mg3N2 + 4NH3↑ ④NH4Cl + NaNH2 NaCl + 2NH3(l)
NaCl + 2NH3(l)
| A.仅①正确 | B.②④正确 | C.全部正确 | D.①②④正确 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA。 |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
下列有关实验操作、现象、解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 |
铜丝变红 |
乙醇和乙醛具有还原性 |
| B |
新生成的AgI浊液中滴入稀KCl溶液,振荡 |
有少量白色沉淀生成 |
AgCl比AgI更难溶 |
| C |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D |
向包有Na2O2粉末的脱脂棉吹气或滴水 |
脱脂棉都会燃烧 |
Na2O2与CO2或水的反应是放热反应 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE有相同类型的化学键