实验室制取Cl2的化学方程式为MnO2 + 4HCl 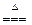 MnCl2 + Cl2↑+ 2H2O,当有146.0克HCl完全参加反时,有多少摩氧化剂被还原?有多少摩还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
MnCl2 + Cl2↑+ 2H2O,当有146.0克HCl完全参加反时,有多少摩氧化剂被还原?有多少摩还原剂被氧化?还原产物为多少克?生成的氧化产物在标准状况下的体积是多少升?(每问3 分)
浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是
2P+5H2SO4(浓)==2H3PO4+5SO2↑+2H2O
若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目。
(2)计算生成的SO2在标准状况下的体积。(写出计算过程)
在200mL0.5mol/L的氯化铝溶液中滴加0.5mol/L的氢氧化钠,得到3.9g的沉淀,求加入氢氧化钠的溶液的体积可能是多少?
0.1mol某烃的衍生物与0.35mol氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了5.4g,通过足量澄清石灰水时,可得到沉淀20g(干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入足量澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出该有机物可能的结构简式和名称。
向一定量的NaOH固体中加入由硫酸铜和硫酸组成的混合物的溶液,充分搅拌,恰好完全反应,有蓝色沉淀生成,过滤,所得滤液的质量与加入的原混合物溶液的质量相等。则与硫酸铜反应的氢氧化钠和与硫酸反应的的氢氧化钠的物质的量之比为?
现有铜、银合金14g与足量的某浓度的硝酸100mL发生反应,将生成的气体与1.12L(标况)氧气混合,通入足量的水中恰好全部吸收,反应后溶液体积仍为100mL。试通过计算回答下列问题:
(1)原固体混合物中铜和银的质量各是多少?
(2)若原硝酸溶液为浓硝酸,反应产生的气体是单一气体,则该反应中被还原的硝酸的物质的量是多少?
(3)合金完全溶解后,若生成的气体在标况下体积为2.24L,反应后溶液中c(H+)=7mol/L,则该混合气体中NO和NO2在标准状况下的体积分别是多少?原硝酸的浓度是多少?