X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化 物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1) 化合物YX3的空间构型为____________; X原子的杂化轨道类型为_______.
(2)XW的电子式是_____________.
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)_________________________ _____.
_____.
(4)Z元素氢化物的沸点比H2O________(填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式_ 
 _.
_.
(5)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0.将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的是________.
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d. 达到化学平衡的过程中气体平均相对分子质量减小
达到化学平衡的过程中气体平均相对分子质量减小
e.到达化学平衡后,升高温度,YX3的体积分数增大
请根据反应:Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计一个原电池。
(1)画出装置图,标明两极材料和电解质溶液,并指出正、负极。
(2)写出两电极上的电极反应式。
2SO2(g)+O2(g)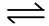 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。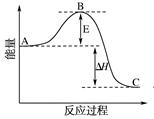
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
图中A、C分别表示________________、________________,
E的大小对该反应的反应热有无影响?______________。
(2)图中ΔH=____________ kJ·mol-1;
(3) 反应速率v(SO2)为0.05 mol · L-1 · min-1,则v(O2)=____________mol · L-1 · min-1、
v(SO3)=____________mol · L-1 · min-1;
(4) 已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________。
下列物质:①N2 ②Na2O③NH3④CO2⑤Na2O2
⑥NaOH⑦CaBr2⑧H2O2⑨NH4Cl⑩HBr。
回答下列问题:(填序号)
(1)只含离子键的是;(2)只含极性键的是;
(3)含有极性键和非极性键的是;(4)含有非极性键的离子化合物是;
(5)含有极性键的离子化合物是。
根据氧化还原反应Fe + 2FeCl3 = 3FeCl2设计一个原电池装置。
(1)电解质溶液为
(2)负极材料,电极反应式
(3)正极材料,电极反应式
下表是元素周期表的一部分,按要求填空:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑪ |
⑫ |
(1)写出下列元素的元素符号:① _______ ②_______ _⑪_______
(2)写出下列元素的名称,最活泼的金属元素是__ ___,最活泼的非金属元素是____ ,
(3)用化学式表示在这些元素的最高价氧化物对应水化物中,酸性最强的是,
碱性最强的是,呈两性的氢氧化物是。
(4)在③与④的单质中,用元素符号表示化学性质较活泼的是,实验验证方法是;在⑧与⑫的单质中,用元素符号表示化学性质较为活泼的是,实验验证的方法是