已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+ H2O(未配
H2O(未配 平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是( )
平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是( )
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
下列有机物的命名中,正确的是
| A.3-甲基-1-丁烯 | B.2-乙基丁烷 |
| C.1,2,3-三甲基丁烷 | D.3,4-二甲基丁烷 |
下列化学用语书写正确的是
A.甲基的电子式: |
B.2-丁烯的键线式: |
| C.丙烯的结构简式:CH2CHCH3 |
D.二乙醇的结构式: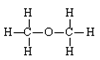 |
“保护环境”是我国的基本国策。下列做法不应该提倡的是
| A.焚烧秸秆,还肥于田 | B.净化废水,循环利用 |
| C.低碳出行,植树造林 | D.开发风能,利用地热 |
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是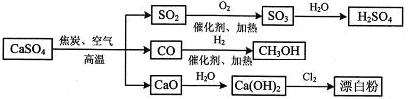
| A.CO、SO2、SO3均是酸性氧化物 |
| B.工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| C.漂白粉的有效成分为Ca(ClO)2 |
| D.除去与水反应的两个反应,图示其余转化反应均为氧化还原反应 |
现有H2SO4、Ba(OH)2、Na2CO3和氯水四种溶液,有如图所示的相互关系,图中每条线段两端的物质可以发生化学反应。下列推断合理的是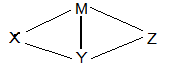
| A.M一定是Ba(OH)2 | B.Y可能是氯水 |
| C.X一定是Na2CO3溶液 | D.Z可能是H2SO4 |