某学生为测定未知浓度的硫酸溶液,以0.1400mol/L的NaOH溶液滴定上述H2SO4,取待测硫酸25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)若使用甲基橙做指示剂,如何确定终点 (2)下列操作将导致测定值高于实际值的是
| A.标准液在“0”刻度线以上,未予调整就开始滴定 |
| B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗 |
| C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视 |
| D.酸滴定管经蒸馏水洗净后,即注入锥形瓶进行中和滴定 |
E.在滴定过程中不慎将数滴酸液滴在锥形瓶外
(3)计算待测硫酸溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
现给你一试管二氧化氮,其他药品和仪器自选。试设计实验,要求尽可能多地使二氧化氮被水吸收。
| 实验步骤 |
现象 |
解释(可用化学方程式表示) |
|
| (1) |
|||
| (2) |
|||
| (3) |
某学生做钠在氯气中燃烧的实验时,使用了崭新的铜制燃烧匙,当钠燃烧时,除了观察到有白烟外,还有少量棕色的烟,能说明这个现象的化学方程式为
__________________,___________________________;将上述反应得到的固体溶于水后再加入NaOH溶液,产生少量蓝色沉淀,该反应的离子方程式为:
__________________________。
吸烟对健康有害,科学实验表明:香烟所产生的烟雾中至少有300多种化合物对人体有不同的危害。为了鉴定该烟雾中是否存在CO2和CO,将香烟燃烧产物的烟雾进行适当处理后,依次通过足量以下试剂:①澄清石灰水;②浓硫酸;③灼热的黑色氧化铜粉末;④澄清石灰水。发现①④中澄清石灰水变浑浊,其他无明显现象。试完成下列问题:
(1)①中现象说明______________________________________________________________。
(2)烟雾中(填“存在”或“不存在”)CO,作出此判断所依据的实验现象为____________。
(3)③中无明显变化的原因可能是
_________________________________________________。
实验室里若用如图1所示装置制取氨气,试用表格形式列出图中装置的错误之处,并用文字简要说明如何改正。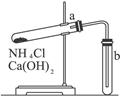
图1
实验室配制500 mL 0.5 mol·L-1的稀硫酸溶液,有如下操作步骤:①把量取好的浓硫酸放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液立即小心地转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度1—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)应该量取____________________mL 18.4 mol·L-1浓硫酸。
(2)上述步骤中第___________步不恰当,正确的操作是:___________________________。
(3)实验操作步骤的正确顺序为(填序号):_______________________________。
(4)本实验用到的玻璃仪器有:__________________________________________。
(5)若出现如下情况,对所配溶液浓度将有何影响?没有进行操作④:________________。加蒸馏水时不慎超过了刻度:____________________。定容时俯视读数:______________。
(6)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度:______________。向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面:__________________。