(1) 实验过程中,可能观察到的主要现象有:
① ;
② ;
③ ;
④ ;
(2) 用该装置做铜与浓硝酸反应的实验,最突出的优点是 。
(3) 若要验证最终得到的气体生成物,最简便的方法是 。
(12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是_______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄 色的物质是:(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是。
色的物质是:(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是。
(2)现提供以下试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。 |
| 同学正确 |
选用试剂 |
实验现象 |
| 第一种方法 |
||
| 第二种方法 |
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: 
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
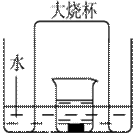
用50m L0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
L0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”)
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
(15)用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用
A.10 mL B.25 mL C.50 mL D.1 00 mL)。
00 mL)。
(2)第③步实验的操作是________________________________(具体操作方法)。
(3)第⑤步实验的操作是________________________________(具体操作方法)。
(4)第④步实验操作的目的是________________________________。
(5)溶液转 移到容量瓶之前需要恢复到室温是因为_______________________________
移到容量瓶之前需要恢复到室温是因为_______________________________ _。
_。
(6)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.定容时俯视刻度线________________
E .定容时加蒸馏水不慎超过了刻度_______________
.定容时加蒸馏水不慎超过了刻度_______________