某小组取一定质量的FeSO4固体,利用下图装置进行实验。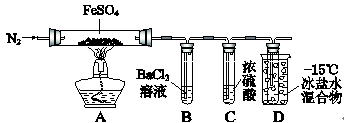
| |
实验过程 |
实验现象 |
| ① |
通入一段时间N2,加热 |
A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② |
用带有火星的木条靠近装置D的导管口 |
木条复燃 |
| ③ |
充分反应,停止加热,冷却后,取A中固体,加盐酸 |
固体溶解,溶液呈黄色 |
| ④ |
将③所得溶液滴入D试管中 |
溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是_______。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_______。
(3)实验④反应的离子方程式是_______。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)_______。
实验室用乙酸和正丁醇制备乙酸正丁酯的原理如下:
CH3COOH+CH3CH2CH2CH2OH  CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
有关物质的物理性质如下表,请回答有关问题。
| 化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/g |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
∞ |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及冷凝回流管,加热冷凝回流反应。
(1)沸石的作用
________________________________________________________________________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是
______________________________;
________________________________________________________________________。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠溶液洗涤。正确的操作步骤是________(填字母)。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下: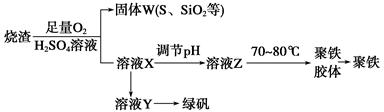
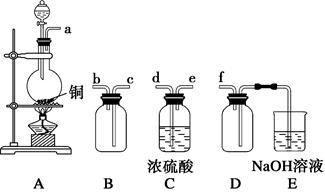
(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。
装置A中发生反应的化学方程式为___________________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
(16)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为mol。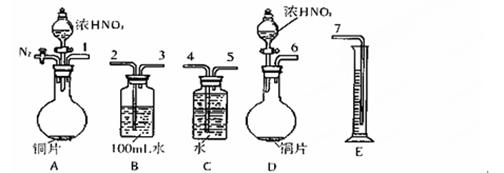
(2)测定NO的体积
①从上图所示的装置中,你认为应选用装置进行Cu与浓硝酸反应实验,选用的理由是。
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标准状况),则Cu与浓硝酸反应的过程中(填“有”或“没有”)NO产生,作此判断的依据是。
(4)实验前,用托盘天平称取的铜片至少应为g。
(10分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下: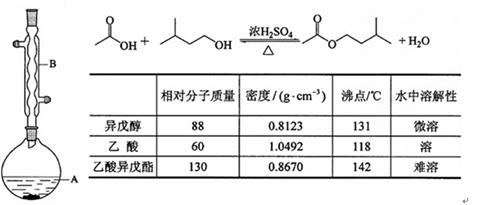
实验步骤:
在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是。
(2)在洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水MgSO4的目的是。
(6)在蒸馏操作中,仪器选择及安装都正确的是(填标号)。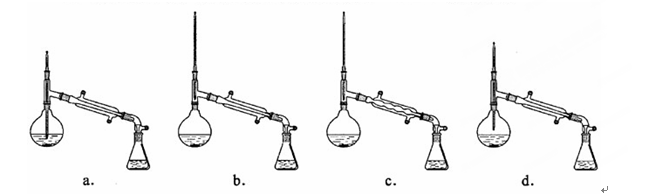 (7)本实验的产率是(填标号)。
(7)本实验的产率是(填标号)。
a.30℅b.40℅ c.60℅ d.90℅
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏(填“高”或“低”), 原因是。
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20=NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。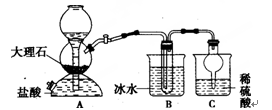
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);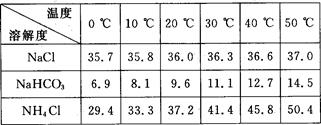
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出
应在装置之间(填写字母)连接一个盛有的洗气装置,其作用。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为。