工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________。
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用__________(填序号)。
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为___ _,充分反应后,加入足量BaC12溶液,经适当操作后得干燥固体2.33g。可推知气体Y中SO2的体积分数为__________。
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是 ,其作用是________________。

(4)为判断CO2是否存在,需将装置M添加在______________(填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为__________。
(5)若C中固体变红,D中固体变蓝,则Q是___________(填化学式),产生该气体的原因是__________。
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为__________(填序号)。
a.SO2 b.H2、SO2 c.H2、 CO2 d.CO2、SO2 e.CO2、SO2、H2
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验 ,写出每一实验鉴定离子的结论与理由。
,写出每一实验鉴定离子的结论与理由。
实验①________________________________________。
实验②_______________________________________。
实验③____ ____________________________________。
____________________________________。
实验④________________________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
实验室用氯化钠固体配制1 的NaCl溶液0.5L,回答下列问题:
的NaCl溶液0.5L,回答下列问题:
(1)请写出该实验的实验步骤:
①计算,②,③,④,⑤洗涤,⑥,⑦摇匀。
用托盘天平(指针向上的)称量样品时,若指 针偏向右边,则表示()
针偏向右边,则表示()
| A.左盘重,样品轻 | B.左盘轻,砝码重 |
| C.右盘重,砝码轻 | D.右盘轻,砝码重 |
需要NaClg,实际用托盘天平称量的质量是g。
(2)所需仪器除托盘天平,还需要哪些玻璃仪器才能完成该实验,请写出:、、、。
使用容量瓶前必须进行的操作是。
(3)从该溶液中取出50mL,其中NaCl的物质的量浓度为。
(12分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的: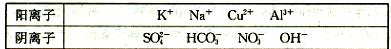
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.若将D的溶液酸化,并加入铜片,则能生成一种气体,该气体遇空气变为红棕色
根据上述实验填空:
⑴ 写出B、D的化学式:B D
⑵ 将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为
⑶ 在A溶液中加入少量澄清石灰水,其离子方程式为
⑷ C常用作净水剂,用离子方程式和适当文字说明其净水原理 
(5)若向含溶质1mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为
克
(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为;
乙同 学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质, 应选用的试剂是。
应选用的试剂是。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是:;
②实验③中溶液变成血红色的离子方程式为。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-(填“大”或“小”)外,还有
(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。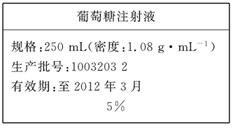
实验用品:葡萄糖晶体(摩尔质量:180 g/mol)、蒸馏水、烧杯、容量瓶(500 mL)、药匙、胶头滴管、量筒。
(1)还缺少的仪器有_。
(2)下列对容量瓶及其使用方法的描述中正确的是__。
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液 时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标有容积、温度和浓度
(3)实验中需取用晶体的质量为____,物质的量浓度__。
(4)配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是__。
A.没有将洗涤液转移到容量瓶 B.定容时俯视读取刻度
C.原容量瓶洗净 后未干燥 D.定容时液面超过了刻度线
后未干燥 D.定容时液面超过了刻度线