(12分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的: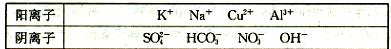
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.若将D的溶液酸化,并加入铜片,则能生成一种气体,该气体遇空气变为红棕色
根据上述实验填空:
⑴ 写出B、D的化学式:B D
⑵ 将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为
⑶ 在A溶液中加入少量澄清石灰水,其离子方程式为
⑷ C常用作净水剂,用离子方程式和适当文字说明其净水原理

(5)若向含溶质1mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为
克
研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了以下装置
①分液漏斗中的A物质是________________(填试剂名称)。
②利用中学常见的仪器,在答题卡中补充完整实验装置(不必画出夹持装置)。可选择的试剂有:稀NaOH溶液、无水氯化钙、稀硫酸、浓硫酸。
③假设实验过程中MgCl2▪6H2O未水解,不用任何试剂用最简单的方法检验MgCl2▪6H2O是否完全转化为MgCl2。写出实验方法________________
④工业生产中得到无水氯化镁可用于电解制备镁单质,电解装置中,镁在____极析出。
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇发生消去反应进行实验。除乙醇外,所需的试剂或用品(不包括仪器)有_________________。
②有的同学探究其它制备乙烯的方法,他设计了以下装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,请分析气体产率很低的原因主要是________________________。为增大气体产率,在右图装置的基础上,提出一点改进措施:__________________。
从实验安全角度考虑,该实验很可能发生的问题是____________________________。
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有(填化学式),实验室萃取操作用到的玻璃仪器有。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为。
(3)第④步加入盐酸作用(答两点即可)。
(4)第⑤步反应的化学方程式。
(5)检验GeO2·nH2O是否洗涤干净的操作是。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为0.105mol,则该样品中GeO2的物质的量为_____ mol。
(16分)甲、乙、丙三位同学在实验室用不同方法制取氮气。
(1)甲同学让空气通过下图所示装置,以除去氧气制得氮气。硬质玻璃管中所盛固体可选用 (填下列选项标号)
A.铁粉B.碳粉 C.过氧化钠 D.碱石灰
(2)收集氮气可选用 (填下列选项标号)
(3)乙同学设计用氨气和炽热的氧化铜反应制取氮气,反应方程式为 。
(4)制取氨气可选用 (填下列选项标号)
A.加热硫酸铵与氢氧化钙混合物
B.加热分解氯化铵晶体
C.浓氨水滴入氢氧化钠固体
D.加热浓氨水使氨气化
(5)丙同学用加热两种含氮溶液制氮气
NaNO2+NH4Cl  NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
该实验装置需要 、分液漏斗、酒精灯等玻璃仪器。
(6)氮气助燃金属镁,反应方程式: ;燃烧3.6 g镁将消耗标准状况下氮气 mL.
有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表。
| 实验 编号 |
温度 |
初始pH |
0.1 mol/L草酸溶液/mL |
0.01mol/LKMnO4溶液体积/mL |
蒸馏水 体积/mL |
待测数据(反应混合液褪色时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
2 |
20 |
50 |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
__________ |
______ |
t3 |
(2)该反应的离子方程式_______________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_______________________________。
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) |
预期实验结果和结论 |
_________________________ |
_________________________ |
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25. 00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是: _______________________;实验中所需的定量仪器有________________(填仪器名称)。该KMnO4溶液的物质的量浓度为_______mol/L。
氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。
注:CCl4与液体石蜡均为惰性介质。
① 发生器用冰水冷却的原因是,液体石蜡鼓泡瓶的作用是。
②从反应后的混合物中分离出产品的实验方法是(填写操作名称)。为了得到干燥产品,应采取的方法是(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 |
得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 |
若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 |
,证明固体中含有碳酸氢铵。 |
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197]