对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ;
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应制取乙醛。装置图如下:(夹持装置均已略去)
供选用试剂:电石(混有CaS等杂质)、HgO粉末、浓H2SO4、NaOH溶液、蒸馏水
资料提示:CaS遇水会产生H2S气体;HgSO4遇到H2S会发生催化剂中毒而失去活性。
回答下列问题:
(1)加入药品前,必须对装置进行的操作是:。
(2)装置B中盛放的试剂为 ,作用是
(3)写出A中发生的主要反应的化学方程式
(4)反应温度应控制在75℃左右,采用E装置的优点是
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置仪器已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。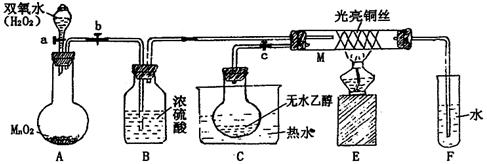
(1)A中发生反应的化学方程式:_______________________________ ,
B的作用:________________________;
(2)M处发生的反应的化学方程式为:______________________________________
(3)该实验过程中催化剂______________ (填“参加”或“不参加”)了化学反应
(4)实验乙醇氧化产物的试剂是,并写出对应的化学方程式
。
(5)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含
有。要除去该物质,可现在混合液中加入(填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
已知乙醇可以和无水CaCl2反应生成微溶于水的CaCl2•6C2H5OH 。
有关试剂的沸点如下:CH3COOC2H577.1℃; C2H5OC2H534.5℃;
C2H5OH 78.3℃; CH3COOH 118℃。
某课外小组用如下图所示装置制备乙酸乙酯粗产品,试回答下列问题:
(1)蒸馏烧瓶中加入的试剂是:冰乙酸、酒精和浓硫酸,
其中浓H2SO4的作用是和。
(2)冷凝管中最先冷凝的馏分是,弃去低沸点的馏分。收集沸点在76℃~120℃
之间的馏分,将其倾倒入饱和Na2CO3溶液中观察到的现象是:。
上述实验中饱和碳酸钠溶液的作用是_____(填序号)
A.中和乙酸和乙醇;B.中和乙酸并溶解乙醇;
C.加速酯的生成,提高酯的产率 D.有利于分层析出。
(3)写出上述实验中用CH3COOH、CH3CH218OH和浓硫酸制备乙酸乙酯的化学方程式:
。
(4)分离出粗产品乙酸乙酯,再加入无水CaCl2,震荡分离的目的是:
为了干燥乙酸乙酯可选用的最佳干燥剂为 ________(填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.固体氢氧化钠
某化学兴趣小组为探究
的性质,按下图所示装置进行实验。
请到答F列问题:
(1)装置
中盛放亚硫酸钠的仪器名称是,其中发生反应的化学方程式为;
(2)实验过程中,装置
、
中发生的现象分别是,这些现象分别说明
具有的性质是和;装置
中发生反应的离子方程式为;
(3)装置
的目的是探究
与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收。
氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(见下表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
㈠制备氧化铜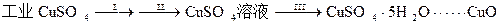
⑴步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是。
⑵步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①这一步骤的目的是,
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是,
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是,水浴加热烘干所得固体。水浴加热的特点是。
㈡探究氧化铜性质
⑴取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是。
⑵为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为。(填写序号)