某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取该溶液进行连续实验,能实现如下转化: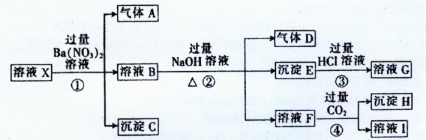
根据以上信息,请同答下列问题:
(1)上述离子中,溶液X肯定含有的离子是 ,不能确定是否含有的离子是 。
(2)气体D的化学式为 ,,沉淀E的化学式为 ,沉淀H的化学式为 。
(3)反应①、②、③、④中,属于氧化还原反应的是 (填序号)。
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:氧化型(蓝色)+ne- 还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。
还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。

图1图2
某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2 g NaOH、100 mL H2O和2 g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从____________导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液_________(填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是_________试管。
(3)上述转化过程中葡萄糖的作用是_________,亚甲基蓝的作用是_________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为____________________________________。
(5)该实验中③④操作_________(填“能”或“不能”)无限次重复进行,理由是______________。
| A.银镜反应实验后附有银的试管,可用稀H2SO4清洗 |
| B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次 |
| C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗 |
| D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度 |
E.用10mL的量筒量取4.80mL的浓硫酸
F.不慎接触过多的氨,及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛
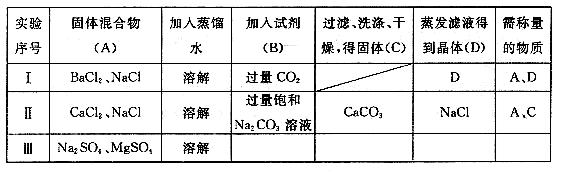
试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________,其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________
要除去表中所列有机物中的少量杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(Ⅰ)试剂:a.NaCl固体;b.NaOH溶液;c.生石灰;d.Na2CO3溶液;e.水;f.浓溴水;g.KMnO4溶液
(Ⅱ)方法:
| A.过滤; | B.萃取; | C.蒸馏; | D.分液;E.盐析;F.重结晶 |
| 要提纯物质(杂质) |
CH3CH2Br(CH3CH2OH) |
C2H5OH(H2O) |
肥皂液(甘油) |
C6H5Br(Br2) |
C6H6(C6H5OH) |
| 选用试剂(Ⅰ) |
|||||
| 分离方法(Ⅱ) |
将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。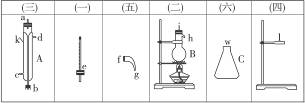
(1)图中A、B、C三种仪器的名称是____________________________________________。
(2)将以上仪器按(一) (六)顺序,用字母a,b,c…表示连接顺序:
(六)顺序,用字母a,b,c…表示连接顺序:
e接_________,_________接_________,_________接_________,_________接_________。
(3)A仪器中c口是_________,d口是_________(填“进水口”或“出水口”)。
(4)蒸馏时,温度计水银球应在_________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是___________________________。
(6)给B加热,收集到沸点60—150 ℃间的馏分是_________,收集到150—300 ℃间的馏分是_________。