无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl3 + 3H2。
完成下列填空: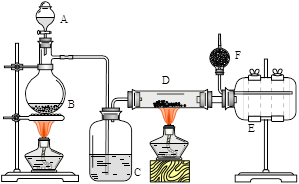
(1)写出B处烧瓶中发生反应的化学方程式:_______________________________________。
(2)C中盛有的试剂为__________。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D、E的目的是_________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是_______________________________________________________。
(4)F中盛有碱石灰,其目的是_________(选填序号)。
a. 吸收HCl b. 吸收Cl2 c. 吸收CO2 d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_____________________________________________。
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由 _________________________。
某课外小组对一些金属单质和化合物的性质进行研究。下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
|
| Ⅰ |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。充分反应后,过滤。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| Ⅱ |
滤液中加入少量的NaOH溶液。 |
有白色沉淀产生。 |
| Ⅲ |
将所得红色固体用蒸馏水洗涤后,加热烘干。 |
少量红色固体变黑 |
Ⅰ反应的离子方程式 ,
Ⅱ反应的离子方程式 ,
Ⅲ反应的化学方程式 。
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题: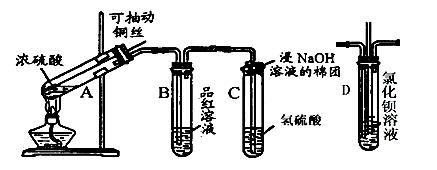
(1)试管C口部的棉团上发生反应的离子方程式是。
(2)反应一段时间后,将B试管中的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液,则发生反应的离子方程式是。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是、、、(要求填二种化合物和二种单质的化学式)。
(5)取下C试管,试管中溶液浑浊,煮沸后,再加入Na2S溶液并加热,溶液变澄清,经测定溶液中主要存在一种摩尔质量为128g/mol的二价阴离子(反应①)。向该澄清液中加入氯水,溶液仍然澄清(反应②),加入氯化钡可得一种不溶于稀盐酸的白色沉淀,写出反应①和反应②的离子方程式,。
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)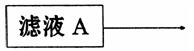
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是(填序号)
| A.铜粉 | B.氨水 | C.氧化铜 | D.氢氧化铜 |
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、
(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是,被还原的n(HNO3)=。
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是(填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是(填序号)。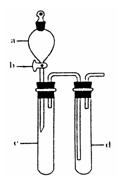
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。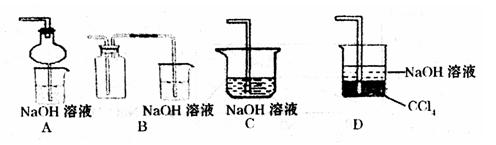
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是原因是
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查阅资料】:Cu2O能溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
【提出假设】:
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?简述你的理由(不需写出反应的方程 式 )。
式 )。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是,写出发生反应的离子方程式,
,。
【探究延伸】:
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为。