某校化学小组的同学将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备硫酸铜和硫酸铝晶体的方案:
回答下列问题:
(1)第①步参加反应的金属有 种。
(2)第②步加入H2O2是因为滤液1中含有 离子。使用H2O2的优点是 。
(3) 用第③步所得CuSO4·5H2O制备无水硫酸铜的方法是: 。
(4)请帮助化学小组的同学完成由滤渣2制取Al2(SO4)3·18H2O 的实验步骤:
①取滤渣2,加入足量的 ,充分反应后过滤;
②取滤液,加入足量的 (填写试剂的化学式),然后 (填写所需实验操作的名称);
(3)用适量稀硫酸溶解;
(4)最后经过 (填写所需实验操作的名称),获得Al2(SO4)3·18H2O晶体。
(1)第③步所得CuSO4·5H2O含有可溶性杂质Na2SO4。为了用重量法测定CuSO4·5H2O的纯度,选用BaCl2(aq)和其他必要的试剂,请列出必须测定的物理量 。
高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 、 。
②配制过程中玻璃棒所起的作用是 。
③下列操作对实验结果的影响偏大的是 (填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:FeSO4 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
②实验时应测定的数据有:量取FeSO4溶液的体积和 。
共海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: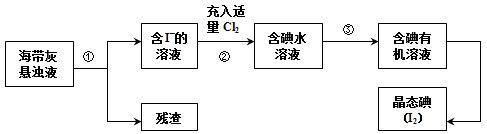
(1)灼烧海带时需要用到的实验仪器是__________________(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A 烧杯 B 坩埚
C 表面皿 D 坩埚钳
E 酒精灯 F 泥三角 G 三脚架
(2)指出提取碘的过程中有关的实验操作名称:①___________,③___________。
(3)操作③中所用的有机试剂可以是___________(只填一种),简述选择其理由______________。
(4)从含有碘的有机溶剂中获取碘,常用水浴加热蒸馏的方法,其优点是_______,最后晶态碘在__________里聚集。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL 0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取该浓盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______;
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为_________ ___;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度线 ;若定容时俯视刻度线____________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线 ;
向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面 。
以下为工业从海水中提取液溴的流程图:
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用“图1”装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞 ,打开活塞 。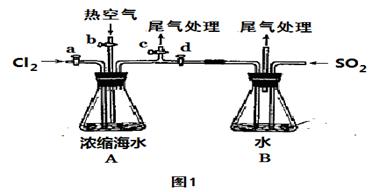
(2)步骤②中可根据 现象,简单判断热空气的流速
(3)步骤③中简单判断反应完全的依据是 。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是 。
(5)步骤⑤用“图2”装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意 装置C中直接加热不合理,应改为 ,蒸馏时冷凝水应从 端进入(填“e”或“f”),图中E、F的作用是 、 。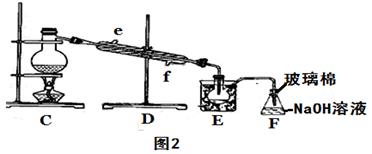
Ⅰ.某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题(已知存在反应:BaCO3+2H+=Ba2++CO2↑+H2O)
(1)操作①一般在____________(填仪器名称)中进行,操作②中玻璃棒的作用是 。
(2)试剂a是 (填化学式),试剂b是 (填试剂名称)。
(3)证明固体C中存在Cl-的方法是__________________________
Ⅱ.从海水中提取的粗盐含有泥沙和Ca2+、Mg2+、SO42等离子,为制备精盐可使用以下试剂:①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液。
(1)加入试剂的合理顺序是 (填选项)。
a.①②③ b.②①③ c.③①② d.③②①
(2)加入过量Na2CO3溶液的作用是 。