碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
| A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大 |
| B.CCl4与I2都是直线型分子,而H2O不是直线型分子 |
C.CCl4和I2都不含氢元素,而H2O中 含有氢元素 含有氢元素 |
| D.CCl4和I2都是非极性分子,而H2O是极性分子 |
下列各图中,表示正反应是吸热反应的是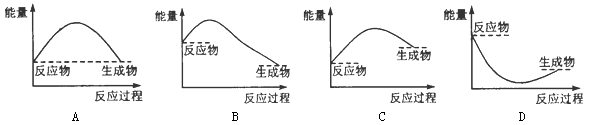
如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是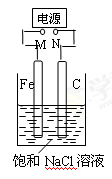
| A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH |
| B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 |
| C.M接负极,N接正极,若把烧杯中溶液换成1 LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B.0.1mol·L-1 NH4Cl溶液中:c(NH4+)+c(NH3•H2O)=c(Cl-) |
| C.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-) –c(CH3COOH)= 2c(H+)- 2c(OH-) |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 molA和2 molB,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
3C(g),若反应开始时充入2 molA和2 molB,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
A.1 molB和1 molC
B.2 molA、1 molB和1 molHe(不参加反应)
C.2molC
D.2 molA、2 molB和3 molC
在100mLH2SO4和CuSO4的混合液中,用石墨做电极电解,两极上均收集到2.24L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为
| A.1mol・L-1 | B.2mol・L-1 | C.3mol・L-1 | D.4mol・L-1 |