将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO 2体积(V)的关系如图,图中AB段表示的先后离子方程式是( )
2体积(V)的关系如图,图中AB段表示的先后离子方程式是( )
①CO2+OH-=HCO3-
②CO2+2OH-=CO32-+H2O
③CO32-+Ba2+=BaCO3↓
④BaCO3+CO2+H2O=Ba2++2HCO3-
⑤CO32-+CO2+H2O=2HCO3-
| A.②⑤ | B.⑤④ | C.④② | D.④① |
某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表
| 物质 |
A(g) |
B(g) |
C(g) |
| 物质的量/mo1 |
1.2 |
0.6 |
0.6 |
下列说法正确的是
A.反应前20s的平均速率为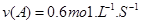
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向FeC12溶液中通入适量C12 |
溶液由浅绿 色变为黄色 |
C12的氧化性比FeC13的强 |
| B |
淀粉溶液在硫酸存在下水解一段时间后直接与银氨溶液混合 |
无银镜出现 |
淀粉没有水解 |
| C |
向澄清石灰水中通入某种气体 |
出现白色沉淀 |
该气体一定是CO2 |
| D |
BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 |
有气体生成 |
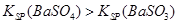 |
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
| A.X与Y能形成两种常见的气态化合物 |
B.原子半径的大小顺序: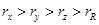 |
| C.X、Z分别与R形成的化合物中化学键类型不同 |
| D.含有Y、Z、R三种元素的化合物最多只有2种 |
NM-3是种正处于临床试验阶段的小分子抗癌药物,其结构如下图所示(未表示出其空间构型)。下列关于NM-3的性质描述正确的是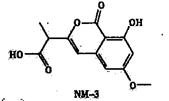
| A.能发生加成、取代、消去反应 |
| B.能使溴的四氯化碳溶液褪色 |
| C.能与FeC13溶液发生显色反应 |
| D.1mo1该物质最多可与2mo1NaOH反应 |
下列有关说法错误的是
| A.NH3(g)+HC1(g)=NH4C1(S)低温下能自发进行,说明该反应的△H<O |
| B.为保护海轮的船壳,常在船壳上镶入锌块 |
| C.纯碱溶于热水中,去污效果增强,说明纯碱的水解是吸热反应 |
| D.反应N2(g)+3H2(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动。 |