化学活动小组的同学用下图所示装置进行实验(装置的气密性良好):先关闭止水夹,将足量氢氧化钠溶液滴入锥形瓶中,充分反应后,再打开止水夹。
⑴锥形瓶中能观察到的现象是;
⑵根据上述现象,能否得出"二氧化碳与氢氧化钠能反应"的结论?为什么?,
⑶设计实验方案,探究反应后锥形瓶内溶液中溶质成份的几种可能情况,填写下表。

实验操作 |
预期的现象和结论 |
|
|
以下是初中化学常见的实验装置图,请回答有关问题
(资料:①为分液漏斗,能控制液体反应物的量)
(1)写出实验室可用
装置制取的一种气体的化学反应方程式;
(2)某同学欲在实验室中用小苏打和稀盐酸制取二氧化碳气体,①应选用的发生装置是(填序号),②该反应的化学方程式是;
(3)现有如下资料:实验室用加热固体氯化铵和熟石灰的混合物制取氨气。氨气是一种密度比空气小且有强烈刺激性气味的无色气体,极易溶于水,形成氨水溶液。则实验室制取氨气的发生装置为(填序号):
(4)若用
装置收集氨气,则气体应从端通人(填
或
):
(5)用
装置检验中氨气是否集满,则
中盛放的试剂可以是;
(6)用
装置吸收尾气时,则
中盛放的试剂可以是。
(3分)某次化学实验后的废液中含有CuCl2和稀盐酸,小红和小方对此废液进行如下无害处理
(1)小红用一种单质将废液中怕Cu2+转化为铜,写出该反应的化学方程式;
(2)过滤后的溶液仍显酸性,小方用一种化合物在不用指示剂的情况下使其变为中性、无害,他用的化合物可能是(答一种即可)。
回答下列有关问题
(1)今年5月31日是第25个"世界无烟日"。吸烟有害健康,请用微粒的观点解释为什么一人吸烟,同样危害周围其他人的健康?。
(2)山区居民长期以当地硬度较高的山泉水为饮用水,饮用前人们都将水煮沸.从健康的角度看,煮沸的目的是①②。
(3)稀释浓硫酸时一定要把浓硫酸沿器壁注入水里,原因是。
化学是一门以实验为基础的学科,请结合下列图示实验装置,回答问题。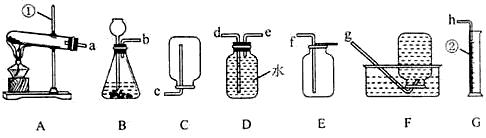
(1)图中①、②仪器的名称是:①;②。
(2)用氯酸钾和二氧化锰固体制取较纯的氧气时,可选用的发生装置和收集装置是(填字母序号),反应的化学方程式是。
(3)小阳欲制取并测定生成氢气的体积,请从上图
中选择最佳的装置进行组合,整套装置的导管口连接顺序是
→(填接口序号)。
(4)小李用锥形瓶收集一瓶二氧化碳气体,并利用下图所示的装置做趣味实验,他将胶头滴管中氢氧化钠溶液挤压到锥形瓶后,可以观察到的现象为,其原因是。
2011年11月,国家环境保护部对外公布《环境空气质量标准》和《环境空气质量指数日报技术规定》征求意见稿,将PM2.5作为一般评价项目纳入标准,PM2.5是指大气中直径小于或等于2.5微米的颗粒物。
(1)大雾天气导致呼吸病人增多因为雾霜可使空气中增加大量的(填字母序号)
| A. | 二氧化碳 | B. | 一氧化碳 | C. | 可吸入颗粒物 | D. | 二氧化硫 |
(2)防PM2.5专用口罩使用了活性炭,这是利用了活性炭的作用。
(3)请你提出一条防治空气污染的合理建议。