氨分解反应2NH3 N2+3H2,在容积为2L的密闭容器中进行。已知起始时氨气的物质的量为4mol,5s时为2.4mol,则用氨气表示该反应的速率为
N2+3H2,在容积为2L的密闭容器中进行。已知起始时氨气的物质的量为4mol,5s时为2.4mol,则用氨气表示该反应的速率为
| A.0.32mol·L-1·s-1 | B.0.16mol·L-1·s-1 |
| C.1.6mol·L-1·s-1 | D.0.8mol·L-1·s-1 |
在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g) 2C(g)+D(s) △H=a kJ·mol-1
2C(g)+D(s) △H=a kJ·mol-1
实验内容和结果分别如下表和下图所示。下列说法正确的是
| 实验序号 |
温度 |
起始物质的量 |
热量变化 |
|
| A |
B |
|||
| Ⅰ |
600℃ |
1 mol |
3 mol |
96 kJ |
| Ⅱ |
800℃ |
1.5 mol |
0.5 mol |
—— |
A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.上述方程式中a=-160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是
| A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
下列实验操作与预期实验目的或所得实验结论不一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将Al2(SO4)3、NaOH溶液相互滴加 |
鉴别Al2(SO4)3、NaOH溶液 |
| B |
向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 |
说明KSP(AgCl)>KSP(AgI) |
| C |
向NaHS溶液中滴入酚酞,溶液变红色 |
HS-水解程度大于电离程度 |
| D |
向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 |
该溶液中一定含有Fe2+ |
化合物M具有广谱抗菌活性,合成M的反应可表示如下:
下列说法正确的是
| A.X分子中有2个手性碳原子 |
| B.Y分子中所有原子可能在同一平面内 |
| C.可用FeCl3溶液或NaHCO3溶液鉴别X和Y |
| D.在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应 |
下列说法正确的是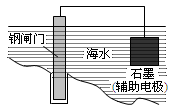
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释, 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |