将一定量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g的铜粉,此时共收集到NO气体448 mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为
| A.5.76 | B.2.88 | C.1.92 | D.0 |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
在容量瓶上没有的标记是
| A.刻度线 | B.温度 | C.浓度 | D.规格(容量) |
下列叙述正确的是
| A.3.01×1023个SO2分子的质量为32g |
| B.CH4的摩尔质量为16g |
| C.1 mol H2O的质量为18g/mol |
| D.标准状况下,1 mol任何物质体积均为22.4L |
下列物质属于非电解质的是
| A.金属钠 | B.CaCl2 | C.H2SO4 | D.SO2 |
在一定条件下,可逆反应:mA+nB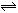 pC达到平衡,若:
pC达到平衡,若:
(1) A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的大小关系是;
(2) A、C是气体,若增加B的量,平衡不移动,则B应为态;
(3) A、C是气体,而且m+n = p,增大压强可使平衡发生移动,则平衡移动的方向必是。
(4) 加热后,可使C的质量增加,则正反应是反应(选填“放热”或“吸热”)。