氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g)  H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数 。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、40. 2 g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
计算25℃时0.7mol·L-1硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10-7 K2=4.7×10-11 |
K=1.75×10-5 |
下列说法正确的是。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH=.
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为:

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,(填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为。
已知: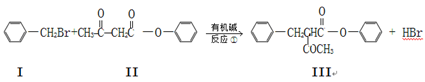
Ⅴ由化合物Ⅲ合成:
请回答下列问题:
(1)化合物Ⅱ的分子式为,Ⅲ的含氧官能团的名称为。
(2)反应①~③中,属于加成反应的是 ____________。
(3)化合物II与足量的H2(Ni作催化剂)加成后再在酸性条件下水解,所得产物之一可以发生聚合反应,写出该聚合产物的结构简式为:______________________________。
(4)1 mol化合物Ⅱ与C9H8的混合物完全燃烧时消耗O2的量为__________mol。
(5)化合物II与NaOH溶液能很快完全反应,写出该反应方程式:。
(6)化合物II也能发生类似反应②的反应得到一种分子中含3个碳原子的有机物,该物质的结构简式为。
(7)写出满足下列条件的IV的同分异构体的结构简式。
①苯环上只有两个处于对位的取代基; ②能发生银镜反应;③核磁共振氢谱有5组吸收峰
已知有机物A~I之间的转化关系如图所示:
①A与D、B与E、I与F互为同分异构体。
②加热条件下新制Cu(OH)2悬浊液分别加入到有机物I、F中,I中无明显现象,F中变砖红色。
③C的最简式与乙炔相同,且相对分子质量为104。
④B的一种同分异构体与FeCl3发生显色反应。
根据以上信息,回答下列问题:
(1) C E中含有的官能团名称分别为______ ________,
(2) H 的结构简式为________________________。
(3)反应①~⑨中属于取代反应的是____________________________。
(4)写出反应⑥的化学方程式_______________。
(5)写出F与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3发生显色反应的G的同分异构体有________种。
有a、b、c、d、f五种前四周期元素,原子序数依次增大,a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b)且其中基态b原子的2p轨道处半充满状态,已知bc2+与ac2互为等电子体,d为周期表前四周期中电负性最小的元素,f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出bc2+的电子式__________,基态f原子的核外电子排布式为___________。
(2)b的简单氢化物极易溶于c的简单氢化物,其主要原因是。
(3)化合物甲由c、d两种元素组成,其晶胞如甲图,甲的化学式___________。
(4)化合物乙的部分结构如乙图,乙由a、b两元素组成,硬度超过金刚石。①乙的晶体类型为________________________,其硬度超过金刚石的原因是_________________________。
②乙的晶体中a、b两种元素原子的杂化方式均为___________________。