碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液 为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
标准状况下,相同质量的下列气体中体积最大的是
| A.O2 | B.SO2 |
| C.Cl2 | D.N2 |
某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2︰4︰1︰1,则M离子可能是下列中的
| A.Cl- | B.OH- | C.Mg2+ | D.Na+ |
人体中正常的的血红蛋白中含有Fe2+,若误食亚硝酸盐,则导致血红蛋白中的Fe2+转化高铁(Fe3+)血红蛋白而中毒,服用维生素C可解除亚硝酸盐中毒。下列叙述中正确的是
| A.亚硝酸盐是还原剂 | B.维生素C发生还原反应 |
| C.维C将Fe3+转化成Fe2+ | D.亚硝酸盐被氧化 |
P单质在反应4P+3KOH+3H2O=3KH2PO2+PH3中是
| A.被氧化 | B.既被氧化又被还原 |
| C.被还原 | D.既未被氧化又未被还原 |
标准状况下,若VL氢气含有的氢原子数为N,则阿伏加德罗常数可表示为
A.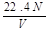 mol-1 mol-1 |
B.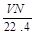 mol-1 mol-1 |
C.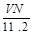 mol-1 mol-1 |
D.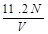 mol-1 mol-1 |