向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 ( )。
| 选项 |
操 作 |
现 象 |
结 论 |
| A |
某气体遇湿润的淀粉碘化钾试纸 |
试纸变蓝 |
该物质一定是氯气 |
| B |
滴加氯水和苯,振荡、静置 |
上层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取少量溶液进行焰色反应 |
火焰呈黄色 |
原溶液一定是钠盐溶液 |
| D |
滴加BaCl2溶液 |
产生不溶于稀硝酸的白色沉淀 |
原溶液一定含有Ag+ |
下列离子方程式书写及评价合理的是
| 离子方程式 |
评价 |
|
| A |
Mg(HCO3)2溶液中加入足量的NaOH溶液Mg2++2HCO3-+2OH-=MgCO3↓+ CO32-+ 2H2O |
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水; |
| B |
1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO2-+5H+ =Al3+ +Al(OH)3↓+H2O |
正确,AlO2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+ |
| C |
将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8 H+= Fe2+ + 2Fe3+ + 4H2O |
正确,Fe3O4化学式可改写为FeO·Fe2O3,Fe2+与Fe3+物质的量之比为1:2 |
| D |
将FeCl2溶液加入到NaClO溶液中 Fe2+ +2ClO-+2H2O = Fe(OH)2↓+2HClO |
错误,Fe2+与ClO-会发生氧化还原反应: 2Fe2+ +ClO-+5H2O =2Fe(OH)3↓+ Cl-+4H+ |
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法正确的是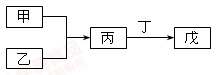
| A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物 |
| B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 |
| C.若丙、丁混合产生大量白烟,则乙可能具有漂白性 |
| D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是
| A.可以用石墨作阳极,作铁阴极 |
| B.除去CN-的反应:2CN-+5ClO-+ 2H+=N2↑+2CO2↑+5Cl-+H2O |
| C.阴极的电极反应式为:Cl-+2OH-+2e-= ClO-+H2O |
| D.阳极的电极反应式为:2CN-+12OH- -10e-=N2↑+2CO32-+6H2O |
下列实验装置正确的是
下列说法正确的是
| A.SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气; |
| B.由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫; |
| C.稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素; |
| D.金属钠通常被保存在煤油或石蜡油中,以隔绝空气; |