下列各组物质中括号中为杂质,请填写除去杂质所用的试剂及反应的离子方程式:
(1).NaHCO3溶液(Na2CO3),用__________ 试剂,离子方程式___________ 。
(2).CO2(HCl),用___________ 试剂,离子方程式 。
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去).已知:常温下,CO能使一些化合物中的金属离子还原,例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl.反应生成黑色的金属钯,此反应也可用来检测微量CO的存在.
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是__________________,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___________(填写“Ⅰ”、“Ⅱ”或“Ⅲ”).若要制取干燥、纯净的CO2,装置B、C中各盛放的试剂分别为______、_________。
(2)装入药品后,在点燃酒精喷灯前,必须进行的操作是___________待装置_______(填写字母)中出现_____________现象时,再点燃酒精喷灯,这步操作的目的是______________。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是__________________。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式(需注明正确的反应条件)是______________________。
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、传统的FeCl3型(HCl-FeCl3)等方法。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有__________、__________(用离子方程式表示).
(2)HCl-H2O2型蚀刻液在蚀刻电路板过程中发生的化学反应用化学方程式可表示为:______________。
(3)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是______________.
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质: NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是_________(写化学式)。
(2)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:_________________;
(3)在反应:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+中,得电子的元素为__________________,5molS2O82-参加反应时转移电子物质的量为_____________。
T ℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。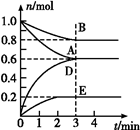
回答下列问题:
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻时,容器中各物质的量如下表所示:
| 物质 |
A |
B |
D |
E |
| 物质的量(mol) |
0.8 |
1.0 |
0.4 |
0.2 |
此时v(正) v(逆)(填“>”或“﹦”或“﹤”)。
已知某浓度的硫酸在水中的电离方程式:
H2SO4=H++HSO4-,HSO4- H++ SO42-。
H++ SO42-。
(1)Na2SO4溶液显__________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c(SO42-)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(SO42-)_________0.029 mol ·L-1(填“大于”,“小于”或“等于”),理由是 。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是 。
| A.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| B.2c(Na+)=c(SO42-)+c(HSO4-) |
| C.c(Na+)>c(SO42-)>c(H+)>c(OH-) |
| D.c(SO42-)+c(HSO4-)=0.1 mol·L-1 |