将11.26克小苏打和纯碱晶体(Na2CO3• 10H2O)的混合物加热充分反应后,残留固体溶于水,配制成100克溶液,所得溶液中Na2 CO3的质量分数为6.36%,试求:
CO3的质量分数为6.36%,试求:
(1)原混合物中含小苏打及纯碱晶体的质量各是多少?
(2)若加热原混合物将失重多少克?
把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0. 2 m
2 m ol·L-1·s-1,同时生成1 mol D。试求:
ol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
以石墨为电极,电解1L硫酸铜和氯化钠的混合溶液,其中硫酸铜与氯化钠的物质的量之和为0.2mol,硫酸铜的物质的量占总物质的量的比值为x。
若x=0.5,当Cu2+在阴极恰好全部析出时,阳极产生的气体是什么?其物质的量是多少?所得溶液的pH是多少?
将镁和铝的混合物0.1 mol溶于100 mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积( V)变化如图所示。请回答:
V)变化如图所示。请回答: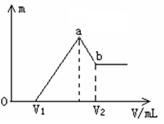
(1)若当V1=160时,则金属粉末中
n(Mg)=mol,V2=mL;
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积应为mL。
过氧化钠与铝粉混合物共18.3 g,加入100 mL水,充分反应 后混合物完全溶解,并收集到5.6 L气体(标准状况)。
后混合物完全溶解,并收集到5.6 L气体(标准状况)。
(1)收集到的气体成份是,体积比是;
(2)计算反 应后溶液中各溶质的物质的量浓度(设溶液体积不变)。
应后溶液中各溶质的物质的量浓度(设溶液体积不变)。
氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中—份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,n(CuO)+n(Cu2O)=。
(2)A中,n(CuO)的取值范围是。
(3)试计算所用稀硝酸的物质的量浓度_______________。