X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化 合价代数和等于6 合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X的气态氢化物分子的电子式是 ,Z元素在周期表中的位置是  。
。
(2)X、Y、Z三元素的最高价氧化物的水化物酸 性由强到弱的顺序是 。
性由强到弱的顺序是 。
(3)常温时,W的硫酸盐溶液的pH 7(填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示) 。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
(附加题4)乙二醛与足量银氨溶液反应的化学方程式
(附加题3)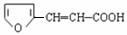 有多种同分异构体,符合下列要求的有________种。
有多种同分异构体,符合下列要求的有________种。
①苯环上有两个或三个取代基
②取代基可能是“醛基、羧基、酯基、羟基
(附加题2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比。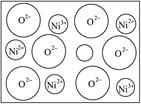
(附加题1)以A和乙醇为基础原料合成香料甲的流程图如下: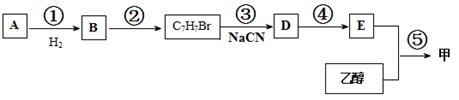
已知:R—Br+NaCN → R—CN+NaBr; R—CN 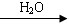 R—COOH
R—COOH
杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全燃烧时,生成15.4g CO2和2.7g H2O。
(1)A的分子式
(2)写出反应⑤的化学方程式
(9分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。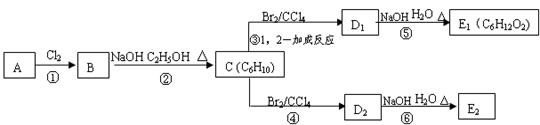
反应②的化学方程式为;
C的化学名称为;
E2的结构简式是;
④、⑥的反应类型依次是
