(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g) CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)= mol/(L·min),此时该反应的平衡常数为 。
CO2(g)十H2 (g),△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率υ(CO)= mol/(L·min),此时该反应的平衡常数为 。
(2)T ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于  状态;c1 0.08 (填 “>”、“<”或“=”)。
状态;c1 0.08 (填 “>”、“<”或“=”)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (填序号,下同),表中5min~6min之间数值发生变化,可能的原因是 。
a.增加了水蒸气的量 b.降低温度
c.使用催化剂 d.增加氢气的浓度
已知:
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是,名称是________
(2)G与F的相对分子质量之差为4,则G具有的性质是_______(填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是_______________,该反应类型是________反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:。
(5)A转化为B和F的化学方程式是。
已知A、B、C、D、E、G、H、I均为气体,J为常见的液态物质,A、B、C、I、M为单质,且M为常用金属,G和H相遇时产生白烟,它们存在如下的转化关系(图中部分反应物或产物已省略),请回答有关问题:
(1)A分子的电子式是 ,G分子的空间构型为 。
(2)常温下,pH值均为5的H溶液和K溶液中由水电离的c(H+)之比为 。
(3)若向X的水溶液中通入G,产生的现象是 ,N与X中都含M的元素,其化合价是否相同 。
(4)写出X+C→Y的离子方程式 。
M与气态J在高温时反应的化学方程式是 。
(5)土壤胶粒带负电,含相同质量A元素的Z和K施用到稻田后,效果更好的是 - (填化学式)。
(6)在通常状况下,若1 g B气体在C气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。
《物质结构与性质》(每空2分,化学反应方程式3分)
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、4、6,且都含有18个电子,其中B、C是由两种元素的原子组成,且B分子中两种元素原子的个数比均为1 :2 ,C分子中两种元素原子的个数比均为1 :1,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是;
(2)从B分子的立体结构判断,该分子属于分子(填“极性”或“非极性”);分子空间结构为_______型。
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式
________________________________________________________________________。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
________________________________________________________________________。
Ⅱ. Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(5)基态Cu原子的核外电子排布式为。
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
(填晶体类型)。
硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为;标准状态下得到4.48升SO2 时,一共转移了mol e-。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是。(每空2分)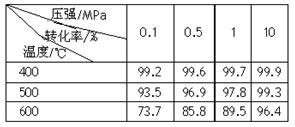
| A.400-500℃ 0.1 MPa | B.400℃10 MPa |
| C.500℃10 MPa | D.400-500℃1 MPa |
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:。若在该条件下将2 mol SO2放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为(用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为。(每空2分)
(15分,每小题各3分)下图中,A到L为常见物质或该物质的水溶液,B在A气体
中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的
元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
|