现有以下物质:
①干燥的食盐晶体 ②镁 ③熔化的KNO3 ④蔗糖 ⑤MgCl2溶液
⑥液态硫酸 ⑦酒精 ⑧氯水 ⑨石墨 ⑩SO3,
请回答:
(1)以上物质中能导电的是 ;(填序号)
(2)以上物质中属于非电解质的是 ;(填序号)
华法林是一种治疗心脑血管疾病的药物,合成路线如下(部分反应条件及试剂略):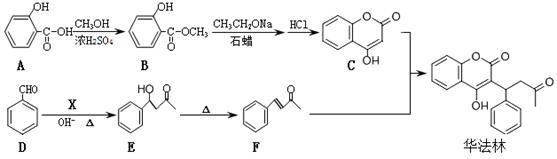
(1)华法林的分子式为 。
(2)B中显酸性的官能团是 。
(3)检验D中含氧官能团所需要的试剂为 。
(4)X的结构简式为 。
(5)A→B的化学方程式为 ,反应类型为 。
(6)请写出满足下列条件的E的同分异构体的结构简式 。
①苯环上只有1个取代基;
②能发生水解反应;
③分子中2个甲基;
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)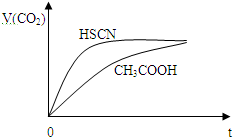
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a.c(CH3COO-)b.c(H+)
c.Kwd.醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。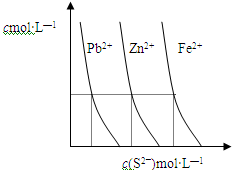
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是 。
②当线路中有0.1 mol电子通过时, 极增重________g
下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| 周期 族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
Ⅷ |
| 1 |
A |
|||||||
| 2 |
B |
C |
L |
|||||
| 3 |
E |
F |
G |
D |
||||
| 4 |
H |
I |
(1)E和G形成的化合物的电子式______________,属于_____________化合物(“共价化合物”或者“离子化合物”)
(2)ABCEFGL中原子半径由大到小排列顺序___________________________(填写元素符号)
(3)ABCDEFGHIL中金属性最强_________非金属性最强__________化学性质最稳定的是________(填元素符号)
(4)F的单质与H的最高价氧化物的水化物反应的离子方程式________________________________。
(5)ABEL形成的化合物______在生活中常被用来制作面包的发酵剂请写出相关化学反应方程式_________。该化合物也能与E的最高价氧化物的水化物反应,请写出相关离子反应方程式____________________。
(13分)根据下列有机物的结构完成问题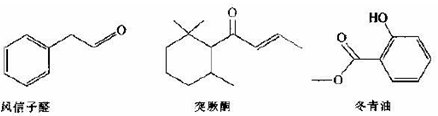
(1)可鉴别风信子醛和冬青油的试剂是 。
(2)下列关于冬青油和突厥酮的说法中正确的是 (填序号)。
| A.都属于芳香族化合物 | B.都能使酸性高锰酸钾溶液褪色 |
| C.突厥酮的分子式为C13H20O | D.都能发生水解反应 |
(3)突厥酮与溴水反应的化学方程式为 。
(4)写出符合下列条件的风信子醛的同分异构体的结构简式______(任写一种);
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜浑浊液共热无砖红色沉淀芳香烃
由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是 (填标号)。
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有 个σ键。
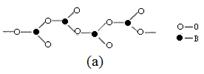
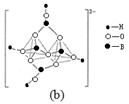
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。