实验室需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,实验操作步骤:
A.用托盘天平称取gCuSO4·5H2O晶体,放在烧杯中,用 适量的蒸馏水使它溶解并恢复至室温。 适量的蒸馏水使它溶解并恢复至室温。 |
| B.用蒸馏水洗烧杯和玻璃棒2—3次,每次洗涤液都小心注入容量瓶,并轻轻振荡 |
| C.继续向容量瓶加蒸馏水,至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。 |
| D.将制得的溶液通过玻璃棒引流,小心地移至容量瓶中。 |
E.将瓶塞塞紧,反复上下颠倒,摇匀。
请填写下列空白:
(1)需称 gCuSO4·5H2O晶体
(2)操作步骤的正确顺序为 (填序号)
(3)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、药匙,
还缺少的仪器是 、 、 。
(4)下列情况会使所配溶液浓度偏低的是 (填序号)
a.定容时俯视。 b.没有进行上述的操作步骤B
c.加蒸馏水时, 不慎超过了刻度线 d.砝码上沾有杂质(或者使用生锈的砝码)
不慎超过了刻度线 d.砝码上沾有杂质(或者使用生锈的砝码)
e.容量瓶使前未经干燥。
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为;化合物A与H2O反应的离子方程式为。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案。
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。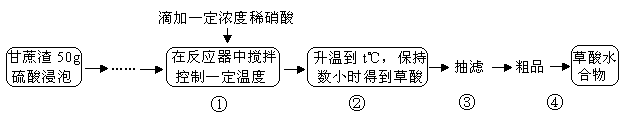
|

三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3+14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
⑤制备过程中可能用到的部分装置如下: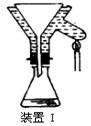


请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
(4)操作A的名称为 ,进行该操作的装置是(填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是。
装置Ⅱ中仪器A、B、C、D的名称分别是、、、。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些?。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: 。
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为:用化学式表示一种由B、C、E组成的物质。
(2)B的氢化物比E的氢化物的沸点(填“高”或“低”),理由是。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。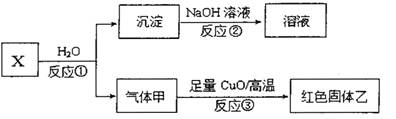
i.写出反应①的化学方程式。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分。
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 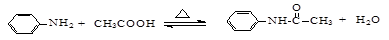
实验参数:
| 名称 |
式量 |
性状 |
密度/g/cm3 |
沸点/℃ |
溶解度 |
|
| 苯胺 |
93 |
无色油状液体, 具有还原性 |
1.02 |
184.4 |
微溶于水 |
易溶于乙醇、乙醚等 |
| 乙酸 |
60 |
无色液体 |
1.05 |
118.1 |
易溶于水 |
易溶于乙醇、乙醚 |
| 乙酰苯胺 |
135 |
白色晶体 |
1.22 |
304 |
微溶于冷水,溶于热水 |
易溶于乙醇、乙醚 |
实验装置:(见右图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,
调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是
(2)为何要控制分馏柱上端的温度在105◦C左右
(3)通过什么现象可判断反应基本完成
(4)步聚1加热可用(填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是。
(5)洗涤乙酰苯胺粗品最合适的试剂是 。
A. 用少量冷水洗 B. 用少量热水洗
C. 先用冷水洗,再用热水洗D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是。