某同学发现一瓶失去标签的药品,取出少量,观察到该药品为白色固体,加入蒸馏水后,发现白色固体全部溶解,他认为该药品有可能是钠的化合物,需要用焰色反应来进一步验证。上述过程没有用到的科学探究方法是
| A.假设法 | B.观察法 | C.比较法 | D.实验法 |
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,B原子最外层电子数是次外层的2倍。A、 E同主族,D、F同主族,且D、F的原子序数之和为
A、E的原子序数之和的2倍,请回答下列问题:
(1)写出下列元素的名称:C____________ E_____________;
(2) A 、C能形成多种化合物,其中C2A4的结构式为______(用元素符号回答,下同);
(3) 化合物E2D2中存在的化学键类型为_______________________________;
(4) 由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为
___________________;
(5) B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为________________________。
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果不正确的是()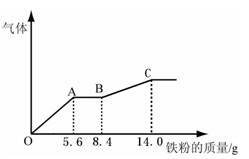
| A.原混合酸中NO3-物质的量为0.2 mol |
| B.原混合酸中H2SO4浓度为2 mol·L-1 |
| C.OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+, BC段产生的气体是氢气 |
| D.第二份溶液中最终溶质为FeSO4 |
在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是()
| A.水、AgNO3溶液、稀HNO3 | B.水、NaOH溶液、稀HCl |
| C.水、KOH溶液、稀HCl | D.水、KOH溶液、稀HNO3 |
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是()
| A.Na和O2 | B.NaOH和CO2 |
| C.NaHCO3和NaOH | D.AgNO3和氨水 |
可逆反应a A(s)+b B(g)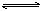 c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
下列叙述正确的是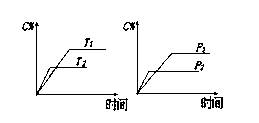
| A.达平衡后,加入催化剂则C%增大 |
| B.达平衡后,若升温,平衡左移 |
| C.化学方程式中c +d > a + b |
| D.达平衡后,增大压强有利于平衡向右移动 |